Einleitung
Der Wunsch nach hoher Mobilität und Sport zieht sich als Phänomen durch alle Altersgruppen. Diese Aktivitäten sind mit hohen Gelenkbelastungen verbunden und stellen damit eine große Herausforderung an degenerativ veränderte Gelenkstrukturen dar. In diesem Zusammenhang ist der orthopädisch tätige Arzt gefordert, die Belastbarkeit von geschädigten Gelenken abzuschätzen, so früh wie möglich präventive Schritte einzuleiten und gegebenenfalls konservative Therapien einzuleiten, um die Progression der Arthrose zu verhindern und damit den eventuell notwendigen Gelenkersatz möglichst weit nach hinten zu schieben.
Grundlagen: Gelenkknorpel und Arthrose
Der Gelenkknorpel besteht beim Erwachsenen zu etwa 5 % aus Zellen, den Chondrozyten oder Knorpelzellen, zu 20 bis 40 % aus Kollagen- und Glykosaminoglykanen als Matrix und bis zu 60 % aus Wasser. Er besitzt keine Gefäß- oder Nervenversorgung. Die Zellernährung erfolgt durch Diffusion. Der Verbund aus Matrix und Wasser bildet die Grundlage für die biomechanischen und viskoelastischen Eigenschaften des Knorpels. Die eingebundene Flüssigkeit im Gelenkknorpel führt bei Belastung zur Dämpfung, und die Abpressung derselben an der Knorpeloberfläche trägt wesentlich zur Gleitfähigkeit und den optimalen Schmiereigenschaften von Knorpel bei. Die Ultrastruktur des Kollagengerüstes und der darin gebundenen Glykosaminoglykane, die für die Wasserbindung verantwortlich sind, stellen das biomechanische Konzept des Knorpels dar. Verletzungen dieser Ultrastruktur durch kritische traumatische Impacts können zu mikrotraumatischen Veränderungen mit Rupturen im Kollagengerüst führen. Nachfolgend kommt es einerseits zur Ausschwemmung der Glykosaminoglykane; andererseits können Traumata zu einem Ausbruch von Knorpelschuppen oder osteochondralen Fragmenten führen. Der isoliert traumatische Knorpeldefekt als Ursprung von Gelenkdegeneration ist häufig, aber durchaus nicht die einzige Ursache der Arthroseentstehung, die einen sehr vielfältigen, auch organischen Hintergrund haben kann und mit einer verminderten Belastbarkeit in osteochondralen Strukturen einhergeht.
Ein Zusammenspiel von intrinsischen und extrinsischen Faktoren ist ursächlich für die Arthroseentstehung. In Summe kann ein komplexes Zusammenspiel von intrinsischen und extrinsischen Faktoren als ursächlich für die Arthroseentstehung angesehen werden. Dabei steht das Dreieck aus Alter – Degeneration – Inflammation im Zentrum 1. Alter ist dabei mit morphologisch abnehmender Knorpeldicke, weniger Proteoglykanen, einer geringeren Kollagendichte und Dedifferenzierungen vergesellschaftet 2. Im Weiteren kommt es zu einem proteolytischen Matrix-Breakdown an der Oberfläche des Knorpels mit beginnender Fibrillation, Aufschwellung des Knorpels, dann Ausschwemmen der Glykosaminoglykane und Zerreißen der Kollagenstrukturen, bis hin zum völligen Knorpelverlust mit Abrieb der Gleitoberfläche. Das Altern auf zellulärer Ebene ist ein geplanter Prozess, der sehr komplex ist und mit dem Auftreten von charakteristischen, seneszenten Zellmerkmalen verbunden ist. Knorpelzellen ändern ihren Status hin zu einem „senescence-associated secretory phenotype“, unter anderem über die Ausschüttung der Mediatoren IL‑1, IL‑6 oder Metalloproteinase‑3. Das gezielte Eliminieren seneszenter Zellen oder Merkmalen mit „Senolytics“ rückt daher bei degenerativen Erkrankungen als vielversprechende therapeutische Strategie in den Fokus 3.
Neben der mechanischen Betrachtungsweise der Gelenkdegeneration setzt parallel auch ein biologischer Prozess der Gelenkdestruktion und des Knorpelabbaus ein. Soul et al. haben in einer rezenten Arbeit zur biologischen Grundlage von Arthrose im Wesentlichen zwei unterschiedliche Osteoarthrosegruppen beschreiben können 4. Die wesentlichen Unterschiede dabei waren die zur Krankheitsinduktion und ‑progression beitragenden Prozesse (Wnt- und TGFβ-Signalwege) zusammen mit einer veränderten Antwort der angeborenen Immunität und Komplementaktivierung.
Grundsätzlich bewirkt der Knorpelabrieb einen synovialen Reizzustand, der über Interleukin‑1 und TNF‑α eine Entzündungsreaktion in Gang setzt. Durch diese Reaktionen werden auch Metalloproteasen (Kollagenasen) freigesetzt, die als zersetzende Enzyme das Kollagengerüst zusätzlich angreifen und rasch zerstören. Dieser entzündliche Vorgang ist auch jener, der für das schmerzhafte Erscheinungsbild der Arthrose hauptverantwortlich ist, das mit Ergussbildung, Bewegungseinschränkung und allgemein eingeschränkter Funktion einhergeht 5. Die Arthrose kann im Wesentlichen alle Gelenke betreffen, hauptsächlich aber steht die Arthrose im Kniegelenk im Vordergrund sowie die im Sprunggelenk, gefolgt von der Hüfte und dem Schulterbereich. Die Entstehung solcher Gelenkschäden wird natürlich durch Verletzungen, die auch im Sport häufig sind, forciert 6. Im Knie sind dies meist Meniskus‑, Kreuzband- und Knorpelverletzungen, im oberen Sprunggelenk Bandinstabilitäten und Knorpelkontusionen sowie Kapselverletzungen an der Hüfte, wo vor allem Labrumläsionen und Hüftimpingements Auslöser eines arthrotischen Prozesses sein können 7 8. Auch dysplastische Veränderungen, wie sie im Bereich des Hüftgelenkes vorkommen, haben vergleichbare Effekte. Die chronischen Überlastungssituationen in Gelenken, insbesondere im Kniegelenk, können besonders durch O‑ und X‑Bein-Stellung akzentuiert werden.
Das osteoarthrotische Gelenk ist vor diesem Hintergrund wie ein komplexes Organ zu betrachten, bei dem äthiopathologische Faktoren übergreifend mechanisch, biologisch und genetisch zu Krankheitsinduktion und Progression beitragen. Dieses degenerativ veränderte Organ hat in Konsequenz auch systemische Auswirkungen auf den Gesamtorganismus; dabei spielen vor allem die zirkulierenden Inflammationsmediatoren eine Rolle 9.
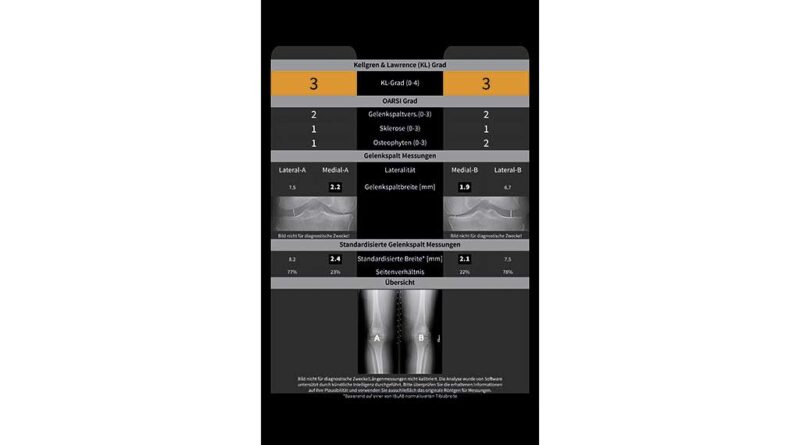
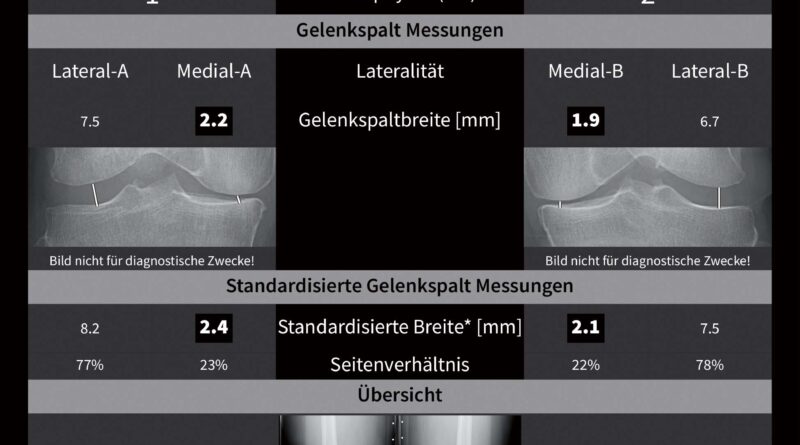
Radiologisch äußert sich die fortschreitende Arthrose durch eine Verschmälerung des Gelenkspaltes, eine Zunahme der subchondralen Sklerose mit progressiver Zystenbildung in den gelenknahen Strukturen, Kalzifizierung und Osteophytenbildung sowie eine zunehmende Achsabweichung aufgrund der damit verbundenen Bandinstabilitäten und Knochendeformationen. Die Gradierung der Arthrose erfolgt in klassischer Weise nach dem Kellgren-Lawrence-Score, der subjektiv semiquantitativ vier Kriterien (Gelenkspalt, Sklerosierung, Verformung und Osteophyten) erfasst, damit aber eine geringe inter- und intraindividuelle Reproduzierbarkeit aufweist. Die Anwendung von digitalen Analyseverfahren in der muskuloskelettalen Bildgebung ermöglicht es, vollautomatisch mithilfe neu entwickelter Algorithmen konventionelle Röntgenbilder auf Frühzeichen einer Arthrose zu untersuchen. Dadurch lässt sich die hohe Befundvariabilität des Kellgren-Lawrence-Scores und damit auch die Datenqualität in Arthrosestudien deutlich verbessern 10. Die Analyse des gesamten Datensatzes eines digitalen Röntgenbildes lässt auch Analysen der ossären Mikrostruktur zu, wobei Aufbau und Zusammensetzung des subchondralen Knochens im Vordergrund stehen. Durch „Deep-Learning“-Algorithmen der Künstlichen Intelligenz können Frühzeichen der Arthrose detektiert werden, wodurch Risikoprofile und Prognosewerte für die Arthroseentstehung generiert werden und somit therapeutische bzw. präventive Maßnahmen rechtzeitig begonnen werden können 11 (Abb. 1).
Muskelatrophie und Arthrose
Die Arthrose ist auf muskulärer Ebene mit sekundären Muskelpathologien assoziiert, nämlich der strukturellen Muskelatrophie und der funktionellen Muskelschwäche 12 13 14. Bewegungseinschränkung als offensichtliche Ursache der Muskelatrophie stellt dabei im Rahmen der Arthroseentwicklung nur einen Teil der vielfältigen Ursachen dar 15. Die arthrogene Muskelinhibition ist ein anderer zentraler Faktor in der graduellen Abnahme von Muskelkraft und ‑masse bei Arthrose. Als Synonym wird in der Literatur der Begriff „Reflexarthropathie“ verwendet. Dies bezeichnet eine spezifische Reaktion des Nervensystems, die sogenannte arthrogene Muskelinhibition 16. Aufgrund von Signalen aus anormalen nozizeptiven Gelenkafferenzen kommt es zu einer Neurotransmitterfreisetzung, die eine Aktivitätshemmung der Alpha-Motoneurone bewirkt und somit eine sekundäre Muskelatrophie durch Muskelminderaktivität verursacht 17.
Muskuläre Dysbalancen sind Folge der Muskelschwäche und führen zu einer Destabilisierung des schon vorgeschädigten Gelenks. Aus der unpräzisen, unkontrollierten Bewegung resultiert eine Gelenkinstabilität mit unkoordinierten Knorpelbelastungen und damit eine raschere Progredienz der Knorpeldegeneration. Assoziierte Schmerzen hindern Arthrosepatienten häufig, einen erneuten Muskelaufbau zu forcieren. Der resultierende Immobilisationszustand führt zu strukturellen Muskelveränderungen mit funktionellen Einbußen, unabhängig von der Dauer der Immobilisation. Es konnten in diesem Zusammenhang eine Reduktion von Muskelfasern, eine Verminderung der Muskelmasse und biomechanische Veränderungen aufgezeigt werden 18 19 20.
In den letzten Jahren wurden mehrere Studien publiziert, die nachweisen, dass Muskelatrophie auch bereits vor Auftreten der ersten Arthrosesymptome besteht 21 22 23 24 25 26. Als multifaktorielle Erkrankung führt die Sarkopenie zu einem generalisierten Muskelabbau mit nachweisbarer Kraftreduktion 27. Hauptsächlich sind ältere Menschen von dieser Sarkopenie betroffen, sie wird aber auch bei jüngeren Erwachsenen beobachtet 28 29 30. Wie bei Muskelatrophie durch Immobilisation ist hier das einzige Therapiekonzept derzeit das regelmäßige Krafttraining. Es sollte dabei ein isokinetisches Muskeltraining durchgeführt werden, bei dem Agonisten und Antagonisten gleichzeitig trainiert werden, bei nur geringem Risiko einer Gelenküberlastung. Das Training muss entsprechend dem Ausmaß der Muskelveränderungen angepasst werden 31, da Personen mit Muskelschwäche und resultierend schlechterer Gelenkstabilisierung ein deutlich erhöhtes Risiko haben, eine fortschreitende degenerative Gelenkveränderung zu entwickeln.
Trainingstherapie
Die Rationale zur Beurteilung einer „physiologischen“ sportlichen Belastung basiert auf dem Verständnis der inneren Biomechanik der Knorpelstruktur; dabei erscheinen zyklische Belastungen mit Be- und Entlastungsphasen notwendig, um die Knorpelzelle zu ernähren. Wie oben beschrieben ist die Knorpelzelle abhängig von Diffusion, die durch den Pumpmechanismus der Belastung aufrechterhalten wird. Da sich die viskoelastischen Fähigkeiten von Knorpel erschöpfen, sind Erholungsphasen notwendig. Dem gegenüber stehen lange statische Belastungen – wie langes Stehen oder langes Sitzen –, die für das Gelenk und die Knorpelstruktur problematisch sein können, da es zum Auspressen der Flüssigkeit und zum Erschöpfen des Schmier- und Dämpfungsmechanismus des Knorpels kommt. Daneben sind kurze Stoßbelastungen, die die Bruchlasten von Knorpel überschreiten, immer problematisch. Diese kommen meist im Rahmen von Traumata vor. In jedem Fall erscheint es wichtig, Reizzustände nach (Mikro-)Traumata oder chronischer Überlastung zu vermeiden, da die vergesellschaftete Inflammation zur progredienten Gelenkdestruktion beiträgt.
Tierexperimentelle Studien zum Einfluss von Bewegung auf Arthrose konnten zeigen, dass moderate Laufbelastungen bei Hunden den Glukosamingehalt und die Knorpeldicke verbessern konnten. Wurden jedoch die Laufinhalte der Tiere deutlich erhöht – vor allem mit höherfrequenten Belastungen mit längeren Umfängen –, konnte eine eindeutige Abnahme der Knorpeldicke und des Glukosamingehaltes festgestellt werden. Niedrigfrequentes, nichtintensives Laufen führte zwar zur Glukosaminabnahme und zu geringer Ausdünnung des Knorpels, parallel jedoch zu einer Verdünnung des subchondralen Knochens ohne Arthrose. Interessant scheint, dass Ausdauertraining mit zyklischer Belastung eine potenziell positive Adaptierung des Gelenkknorpels zu erlauben scheint und so zu einer Adaptation der Belastbarkeit von Knorpel führen kann. Interessant war auch, dass die Regeneration von Gelenkstrukturen – insbesondere des Knorpels nach länger dauernden Ruhigstellungen – durch übertriebene Laufbelastungen negativ beeinflusst wurde, was den Hinweis gibt, nach längeren Sportpausen einen sorgsamen Wiederaufbau der Belastung auch in diesem Zusammenhang durchzuführen 32.
Bei Sportausübung vom Menschen ergibt sich ein ähnliches Bild in den Studien. Ein erhöhtes Arthroserisiko wurde bei Spitzenläufern festgestellt, wo vor allem hochintensive Langzeitbelastungen mit hohen Schrittfrequenzen und hohem Tempo langfristig das Arthroserisiko steigern. Interessant erscheint auch die Beobachtung, dass Spitzenathleten, obwohl sie teilweise doch vermehrt Arthrosezeichen haben, in der klinischen Symptomatik deutlich besser abschneiden als Patienten mit ähnlichen radiologischen Arthrosezeichen, die nicht Sport betrieben haben. Für moderates und mittelmäßig intensives Training konnten verschiedene Autoren feststellen, dass kein erhöhtes Arthroserisiko vorliegt und sogar eine bessere Gelenkfunktion zu erwarten ist 33. Die Umfänge, die hier angegeben werden, liegen ungefähr bei 5 h oder 40 km/Woche, wo auch nach langjährigen (5–9 Jahren) Beobachtungen keine vermehrte Arthrose festgestellt werden konnte. In einem Konsensus-Paper von Bosomworth (2009) wurde auch festgehalten, dass moderate Sportausübung, insbesondere Laufen, primär kein Arthrosefaktor ist 34. Spitzensportler und Eliteläufer haben zwar eine erhöhte Arthrosetendenz zu erwarten, entwickeln dabei aber meist weniger Beschwerden und Einschränkungen. Außerdem sind Sportarten mit abrupten Krafteinwirkungen, hohen Scherkräften und Gegnereinwirkungen immer mit erhöhtem Arthroserisiko, nicht zuletzt aufgrund der posttraumatischen Veränderungen, verbunden. In jeder Diskussion über Artroseentstehung muss jedoch auf die zentrale Bedeutung von Übergewicht und Achsfehlstellungen als prädominante Faktoren in der Arthroseentstehung gegenüber Sport hingewiesen werden, die sich in ihrer Kombination potenzieren 35 und deutlich höher als die Sportpartizipation einzuschätzen sind.
Die Fortführung von Bewegungstherapie und Sport bei bereits eingetretener Arthrose erscheint mit geringen Einschränkungen der Gelenkfunktion verbunden und lässt bei entsprechender Ausführung gute sekundärpräventive Effekte erwarten. Darüber hinaus ist der allgemeine präventive Effekt von Ausdauersportarten – wie Laufen – auch sportmedizinisch abgesichert. Neuere Studien konnten zeigen, dass moderates Training, vor allem mit isometrischen und isokinetischen Trainingsmethoden, die klinische Performance von Arthrosepatienten deutlich verbessern konnte; auch bewegungsarme Patienten profitierten von strukturierten Aktivitätsprogrammen. Problematisch ist einerseits die Implementierung von nachhaltigen Präventionsprogrammen, die über die Jahre durchgeführt werden müssen, und andererseits, dass es eine geringe Dosis-Wirkungs-Korrelation hinsichtlich der Effizienz von Sporttherapie gibt 36 37.
Die häufigste Komorbidität mit Arthrose ist das Übergewicht, wobei vor allem der Fettanteil entscheidend ist für die Korrelation zur Osteoarthroseinzidenz; daher ist die Modifikation der Ernährungsgewohnheiten nicht nur eine qualitative, sondern auch eine quantitative Maßnahme, um Adipositas abzubauen. Daher ist das Übergewicht der wichtigste modifizierbare Risikofaktor, wobei hier der Grenzwert bei einem BMI von über 27 bis 30 liegen dürfte, der zur massiven Erhöhung der Arthroseinzidenz führt.
Hinsichtlich Alter und Geschlecht sind Frauen fast doppelt so häufig betroffen wie Männer
Wenn man nun die Faktoren der Arthroseentstehung und der möglichen Beeinflussung gegenüberstellt, können folgende Risikofaktoren für Osteoarthrose festgestellt werden: Hinsichtlich Alter und Geschlecht sind Frauen fast doppelt so häufig betroffen wie Männer, wobei es in beiden Altersgruppen mit zunehmendem Alter zur Erhöhung und Angleichung der Inzidenz von Arthroseveränderungen kommt. Die Arthroseprozesse sind auch von der hormonellen Situation beeinflusst, wobei die Arthroseentstehung mit Veränderung von Geschlechtshormonrezeptoren im Knorpel einhergeht. Der genetische Hintergrund erscheint mehr und mehr von Bedeutung, wobei hier einerseits die angeborenen Gelenkachsen betroffen sind, andererseits aber auch spezifische genetische Veränderungen, speziell im Kollagenstoffwechsel, mit erhöhten Arthroseraten verbunden sein können. Angeborene muskuloskelettale Fehlanlagen, anatomische Variationen und Dysplasien stellen einen weiteren Block schwer zu beeinflussender, prädisponierender Faktoren dar und lassen den Begriff der idiopathischen Arthrose etwas relativ erscheinen, da keine optimale anatomische Gelenkanatomie vorgegeben ist. Zuletzt müssen neben Stoffwechselerkrankungen mit Gelenkbeteiligung wie der Gicht auch Erkrankungen mit rheumatischem und immunologischem Hintergrund in die Betrachtung eingeschlossen werden.
Die Gesamtbelastung ist treibender Faktor für die Beurteilung des Arthroserisikos
Physische Aktivität und Bewegungsinzidenz sind auch entscheidend mit der Ausbreitung von schmerzhaften Veränderungen des Bewegungsapparates verknüpft. Zu beachten bleibt, dass der Arthrosegrad oft nicht mit dem Ausmaß der Schmerzsymptomatik korreliert. Koordinative Defizite und mangelnde muskuläre Sicherung im Bereich der Band-Gelenk-Kapsel und Sehnenansätze führen zu schmerzhaften Veränderungen, die mit Arthrose kombiniert sein können. Oft ist die Klinik des Patienten vordergründig darauf zurückzuführen und weniger auf den Knorpelschaden selbst, daher ist eine differenzierte klinische Untersuchung wichtig. Irreführend kann die isolierte Betrachtung von Sport sein, ohne die Belastungen aus Freizeit und Arbeit mit einzuberechnen. Denn die Kumulation davon, also die Gesamtbelastung, ist treibender Faktor für die Beurteilung des Arthroserisikos.
Trotzdem erscheint die Erhaltung der Bewegung in der Arthrosedynamik wichtig, und es wurden daher in der Publikation von Roddy und Zhang 38 diesbezügliche evidenzbasierte Empfehlungen für das Management der Osteoarthrose der Hüfte und des Knies im MOVE-Konsensus publiziert. Hier wurde festgestellt, dass die Evidenz im Zusammenhang mit Sport und Arthrose einen generell positiven Effekt gibt und dass diese spezifischen Sportempfehlungen zwar wirksam sind, aber es nur zu einer geringen Dosis-Wirkungs-Korrelation kommt. Insgesamt wird das Widerstandstraining im Sinne eines isometrischen Trainings empfohlen. Vordergründige Rationale für die Sportempfehlung bei Arthrose ist die Wiederherstellung der muskulären Kraft und Koordination. Somit kann und soll das oben beschriebene Zusammenspiel von Immobilität und Arthroseprogression unterbrochen werden. Diese Verbesserung der Gelenkfunktion führt zur Linderung des Reizzustandes und damit zu einer Schmerzreduktion, die sich auch in der Knorpelmorphologie mit einem Erhalt der Knorpeldicke verifizieren lässt.
Die Sporttherapie muss in Bewegungsprogrammen durchgeführt werden 39, die zunächst physiotherapeutisch geübt und gelernt werden sollen. Dringend zu empfehlen ist dabei die Erhebung des Ausgangszustandes, um eine individuelle Abstimmung auf Bewegungsumfang und Intensität zu gewährleisten und Überbelastung zu vermeiden. Voraussetzung ist hier auch, wie überall im Sport, eine sportmedizinische Untersuchung, um die generelle Sporttauglichkeit festzustellen. Letztendlich müssen die Bewegungsprogramme auch im Rahmen eines Heimtrainings durchgeführt werden. Es hat sich gezeigt, dass der Erfolg solcher Programme nur durch fix geplante Nachuntersuchungen und Auffrischungseinheiten erreicht werden kann 40 41.
Sportberatung bei Arthrose und Sporttauglichkeit
Die Beratung bei Arthrose zielt vor allem auf die Erhebung der anamnestischen Vorschädigung und Erkrankungen ab. Eine genaue Anamnese von Traumata und deren nachfolgender Behandlung mit der Erfragung der Dauer von Ruhigstellungen ist wichtig. Aber auch Erkrankungen wie Hüftdysplasien, Bindegewebs- und Stoffwechselerkrankungen müssen erfasst werden.
Nachfolgend ist eine Erhebung der Gelenkachsen sowie Gelenk- und Muskelfunktionen wichtig, um die Funktionalität des muskuloskelettalen Systems zu dokumentieren. Schmerzhafte Sensationen sind diagnostisch zu erfassen, wobei auch eine radiologische Abklärung anzuraten ist. Bei persistierenden oder inadäquaten rasch zunehmenden Schmerzsensationen sollte auch eine MRT zur Abklärung der Gelenkstrukturen, vor allem im Hinblick auf Knochenmarködeme, Synovitis mit Infekt und Tumor, durchgeführt werden. Die muskuläre Stabilisierung und die damit verbundenen koordinativen Fähigkeiten können durch einfache Übungen und Tests wie den Einbeinstand, Up-and-Go oder Gehdistanztests erhoben werden. Bei der sportspezifischen Anamnese ist vor allem entscheidend, inwieweit die Sporttechnik vor Entstehung der Arthrose schon beherrscht wurde. Beim Neuerlernen von Sportarten mit arthrotischen Gelenken ist oft die mangelnde Koordination ein Hindernis, da die schmerzhafte Blockade oder eingeschränkte Gelenkfunktionalität ein Erlernen der Bewegungen kaum möglich macht.
Besonders geeignet für Arthrosepatienten erscheinen Sportarten wie Radfahren beziehungsweise Ergometertraining, Wandern mit Stöcken oder Nordic Walking, Skilanglauf im klassischen Stil oder Wassergymnastik 42 43. Speziell beim Radfahren erscheint die zyklische Bewegung in entlastender Sitzposition für die untere Extremität besonders günstig. Bei schon eingeschränkter Beweglichkeit ist vor allem das Fahrradergometer zu empfehlen, was die Koordination zum Auf- und Abstieg erleichtert. Durch das Verwenden eines Damenrades oder eines Rades mit niedrigem Holm kann das Absteigen im Gelände gut erleichtert werden. Eine entsprechende Gangschaltung, aber auch die Wahl der Touren und die Ausrüstung sind hier entscheidend für die Gelenkbelastung. Beim Nordic Walking ist die Verminderung der Belastung im Bereich der Gelenke der unteren Extremität doch etwas geringer als zunächst angenommen. Durch die Verwendung der Stöcke wird der Schritt etwas größer, somit auch teilweise die Krafteinwirkung höher, sodass dies nur bei gutem Beherrschen der Sportart empfohlen werden kann. Uneingeschränkt sind aber Gehstöcke beim Bergwandern zu empfehlen; diese sollten aber längenverstellbar sein und variable Griffhöhen haben, damit die Abstützung optimal ans Gelände angepasst werden kann.
Sportarten mit höherem technischem Anspruch sollten – wie bereits erwähnt – schon vor der Arthroseentstehung beherrscht werden, da ein Erlernen mit Arthrose schwierig oder unmöglich ist. Zu diesen Sportarten zählen vor allem Tennis, Golf, Skilauf, Tischtennis, Segeln und Reiten. Bei entsprechender Erfahrung und Akzeptanz des etwas eingeschränkten Leistungsniveaus können diese Sportarten durchaus weiter betrieben werden. Wichtig erscheint hier das Verwenden von gedämpften Schuhen, eventuell Gehhilfen, Orthesen oder beim Golfen das Verwenden des Carts. Die Modifikationen der Technik – wie beim Tennis ohne ausgeprägte Rumpfrotation oder beim Golfen unter Durchführen des Golfschwunges ohne entsprechende Körperverdrehung und Knieausgleichsbewegung – sind diese Sportarten durchaus sinnvoll. Ungeeignete Sportarten bei Arthrose sind Mannschaftssportarten oder Sportarten, die mit hohem Tempo und nicht vorhersehbarem Richtungswechsel oder Gegnereinwirkung verbunden sind. Hier sind zum Beispiel Squash, Trampolinspringen, Basketball, Handball, Fußball oder auch Disziplinen wie Gewichtheben und leichtathletische Disziplinen anzuführen.
Gelenkentlastung als Arthroseprävention
Als Prinzip der Arthroseprävention können zyklische Belastungen und Bewegungen als zentraler Faktor genannt werden. Zyklische Belastungen erhalten die Funktionalität von Knorpel und Gelenk insbesondere durch die dadurch verbesserte Ernährung der Knorpelzellen durch Diffusion. Um diesen Effekt optimal nutzen zu können, müssen diese Bewegungen allerdings bei möglichst minimierter Belastung und Krafteinwirkung ausgeführt werden. Daher stellt Radfahren oder Wandern mit Stöcken eine sehr geeignete präventive Intervention dar. Weiter ist die Anwendung von entlastenden Orthesen bei den frühen Arthrosen sicher sinnvoll. Hier können knieübergreifende oder korrigierende Fuß- und Unterschenkelorthesen helfen, den Knorpel und den subchondralen Knochen zu entlasten. Fußunterschenkelorthesen (z. B. „Agilium Freestep “, Otto Bock HealthCare, Duderstadt, Deutschland) haben den Vorteil, dass sie zu keiner Muskelatrophie führen und die muskuläre Gelenkstabilität erhalten bleibt. In einer vergleichenden Studie konnte gezeigt werden, dass die Schmerzsituation durch beide entlastenden Orthesen deutlich verbessert werden kann. Ähnliches gilt auch für die Verwendung von Einlagen mit geringer lateraler Keilung bei beginnenden medialen Arthrosen, was ebenfalls die mechanische Gelenkachse aus dem überlasteten medialen Kompartiment bringt. Die dadurch gesetzten Maßnahmen können verhindern, dass Reizzustände entstehen, damit der entzündliche Zustand, der den Knorpel nachhaltig schädigen kann, verhindert wird.
Behandlung der frühen Arthrose
Tritt im Zuge einer Bewegungsbelastung oder oft auch ohne Anlass ein Reizzustand im Sinne einer Aktivierung der Arthrose auf, ist sofort ein passageres Sportverbot einzuhalten, bis die Schmerzen, der Erguss und die Überwärmung des Gelenkes abgeklungen sind. Kältetherapien lokal und generell, passagere komplette Entlastung mit Krücken und abschwellende physikalische Maßnahmen sowie eine lokale oder/und systemische antiinflammatorische Therapie ist einzuleiten 44. Grundsätzlich unterscheiden wir zwischen topischen, systemischen und infiltrativen Therapien.
Die lokal topische Behandlung hat sich hier als sehr gut verträglich etabliert, wobei NSAR-Gele auch zusammen mit Ultraschallbehandlungen angewandt werden. Im Idealfall reduziert die Behandlung sowohl die Schmerzen als auch das Fortschreiten der Arthrose, was bislang noch für kein Medikament ausreichend bewiesen ist. Durch die topische Behandlung mit NSAR kann bei 60 % der Patienten eine 50-prozentige Schmerzreduktion erreicht werden 45. Paracetamol wird häufig bei Arthroseschmerzen verwendet, wenngleich die Wirksamkeit hier unter den Entzündungshemmern liegt. Capsaicin kann bei moderater Arthrose als lokale Schmerztherapie eingesetzt werden. Die Infiltration von Hyaluronsäure wird international kontrovers diskutiert, da die Studien keinen minimalen relevanten Therapieeffekt nachweisen können, was dem hohen Placeboeffekt der Kontrollgruppen geschuldet ist. In experimentellen Studien konnte ein antientzündlicher Effekt nachgewiesen werden, wobei direkte Effekte des Hyaluronsäure-Rezeptors CD44 anzunehmen sind 46. Durch das hohe Molekulargewicht der therapeutisch eingesetzten Hyaluronsäure wird anstatt einer Aktivierung die gewünschte Hemmung von CD44 erreicht. Die verschiedenen Formen von „platelet rich plasma“ (PRP) besitzen ebenfalls antientzündliche Eigenschaften und werden vor allem in der leukozytenarmen Form eingesetzt. In einem systematischen Review wurde ein positiver Effekt von PRP bei Arthrose nach 12 Monaten konstatiert 47.
Die Infiltration von Glukokortikoiden wird aufgrund der Wirksamkeit bei Gelenkergüssen bzw. Begleitsynovitiden, die in ca. 50 % der Fälle auftreten, häufig praktiziert, sollte aber nicht mehr als dreimal pro Jahr wiederholt werden. Die intraartikuläre Injektion von Steroiden führt zur Veränderungen der Zellaktivität der Knorpelzellen im Sinne eines katabolen Zustandes, der zu einer Verminderung des Knorpelvolumens und einer Apoptoseinduktion führen kann 48. Der oft gleichzeitig durchgeführten intraartikulären Applikation von Lokalanästhetika wird auch eine Knorpeltoxizität zugeschrieben, was aber oft in Kombination angewendet wird. Beide Effekte können durch die Beigabe von Hyaluronat gehemmt und verbessert werden, sodass jetzt zunehmend Mischpräparate mit Hyaluronat und Kortison angeboten werden.
Eine zuletzt publizierte Studie von Filardo mit vergleichender Metaanalyse der injizierbaren Knorpeltherapeutika zeigte vor allem bei längeren Beobachtungszeiträumen Vorteile von PRP gegenüber Hyaluronsäure und insbesondere gegenüber Cortison, das nur sehr kurz wirksam ist und darüber hinaus ausgeprägte Veränderungen in der Gelenkhomöostase bedingt 49.
Die Unterstützung mit „Chondroprotektiva“ kann sinnvoll sein, sollte aber nur als flankierende Maßnahme gesehen werden. Hier kann keine definitive Entscheidung bezüglich der Substanz, in welcher Form und Dosis hier behandelt werden soll, gegeben werden. Im klinischen Alltag wird Chondroitin und Glukosamin eher in der Frühphase der Arthrose angewendet, wenn die Syntheseleistung der Knorpelzellen noch intakt und der Knorpel-Matrix-Aufbau noch als realistisch einzuschätzen ist, was aber prinzipiell als sehr eingeschränkt angesehen wird. Chondroitin und Glukosamin sind weitgehend ohne Nebenwirkungen, haben aber auch ein geringes antiinflammatorisches Potenzial und verfügen – wie auch andere Nahrungsergänzungsmittel – über einen starken Placeboeffekt. Es liegen positive Studien zu Glukosamin (1500 mg/Tag) oder Chondroitin (800 mg/Tag) vor, allerdings ist deren Effekt insgesamt als gering einzuschätzen 50. In einem systematischen Review wurden 20 verschiedene Nahrungsergänzungsmittel bei Knie‑, Hand- und Hüftarthrose untersucht, wobei klinisch signifikante, aber nur kurzfristige Schmerzwirksamkeiten (< 3 Monate) für mehrere Substanzen berichtet wurden (L‑Carnitin, Pinienrindenextrakt, Weihrauchextrakt, Curcuma-longa-Extrakt, Passionsfruchtextrakt und Kollagenhydrolysat) 51. Vier weitere Substanzen hatten nur tendenzielle, gering signifikante Wirksamkeit (undenaturiertes Kollagen Typ 2, Avocado, Sojabohnen-Bestandteile, Methylsulfonylmethan und Diacerein).
In einer Studie mit Vitamin D konnte kein Vorteil gegenüber Placebo in Bezug auf Schmerz und Knorpelvolumen gezeigt werden 52, wobei aber die Erhaltung des subchondralen Knochens und die Vermeidung von periartikulärer Osteopenie wichtig erscheint. Daher zielen neuere Behandlungsansätze auf den pathologischen subchondralen Knochenumbau, welcher bei der Arthrose häufig noch vor dem Knorpelschaden auftritt, wie wir dies in den digitalen Analysen des subchondralen Knochens auch gesehen haben. Hier zeigte sich in verschiedenen Studien ein positiver Effekt von Bisphosphonaten und Strontiumranelat 53. Letzteres wurde allerdings aufgrund einer Sicherheitswarnung nicht weiterverfolgt.
Zuletzt bleibt die Akzeptanz des Patienten gegenüber bestehenden Schäden, was besonders bei frühen arthrotischen Veränderungen die Wahl von Sportarten und Belastungen betrifft, die der eingeschränkten Tragfähigkeit gerecht werden. Diese psychologische Komponente und die persönliche Motivation ist im Therapie- und Betreuungskonzept gleichberechtigt mit den anderen Interventionen umzusetzen. Bei Berücksichtigung der beschriebenen Faktoren kann durchaus auch beim Vorliegen arthrotischer Veränderungen noch befriedigend Bewegung und Sport durchgeführt werden, was mit dem Erhalt der Mobilität und der eigenen Gelenke im Altersgang ein wesentlicher Beitrag zur Lebensqualität ist.
Fazit für die Praxis
- Osteoarthrose ist ein weitverbreitetes Krankheitsbild, welches zu einer zunehmenden Beeinträchtigung der Mobilität von Betroffenen führt. Im Zentrum der Genese steht die Trias aus Alter – Degeneration – Inflammation.
- Aufgrund des demografischen Wandels wird die relative und absolute Zahl Betroffener zunehmen.
- Prävention spielt eine entscheidende Rolle. Die Früherkennung hilft, präventive Maßnahmen rechtzeitig zu setzen.
- Zukünftig können Methoden der Künstlichen Intelligenz mithelfen, objektiver und frühzeitiger zu diagnostizieren und zu therapieren.
- Die konservative Therapie kennt viele Methoden, die auch „regenerative“ Therapien wie autologe Blutprodukte in einen evidenzbasierten Behandlungsalgorithmus einfließen lassen. Sport- und Bewegungsadaptation steht dabei an oberster Stelle.
- Ziel der konservativen Therapie ist es, durch die Kombination mehrerer Methoden – Lebensstiladaptation, Sportanpassung, Gelenkhomöostase, muskuläre Balance etc. – die Mobilität zu erhalten, zu fördern und eventuell nötige Operationen hinauszuzögern oder obsolet werden zu lassen.
Hinweis:
Dieser Artikel ist eine Zweitveröffentlichung des folgenden Artikels: Nehrer S, Neubauer M. Möglichkeiten und Grenzen der konservativen Therapie der Arthrose: Sportberatung, Trainingstherapie, Orthesen und Knorpeltherapeutika [Possibilities and limits of conservative treatment for osteoarthritis : Sport advice, training therapy, orthotics and cartilage therapeutics]. Der Orthopäde, 2021; 50 (5): 346–355. doi: 10.1007/s00132-021–04100‑0.
Für die Autoren:
Prof. Dr. Stefan Nehrer
Fakultät für Gesundheit und Medizin
Department für Gesundheitswissenschaften, Medizin und Forschung
Zentrum für Regenerative Medizin
Universität für Weiterbildung Krems (Donau-Universität Krems)
Dr.-Karl-Dorrek-Straße 30
3500 Krems
Österreich
Stefan.Nehrer@donau-uni.ac.at
Begutachteter Beitrag/reviewed paper
Nehrer St, Neubauer M. Möglichkeiten und Grenzen der konservativen Therapie der Arthrose – Sportberatung, Trainingstherapie, Orthesen und Knorpeltherapeutika. Orthopädie Technik, 2022; 73 (7): 34–41
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- iOrt – Entwicklung einer überwachenden Orthese mit neuartigem optischen Sensorsystem — 11. Februar 2026
- Sacitharan PK, Vincent TL. Cellular ageing mechanisms in osteoarthritis. Mamm Genome, 2016. doi: 10.1007/s00335-016‑9641‑z
- Lotz M, Loeser RF. Effects of aging on articular cartilage homeostasis. Bone, 2012. doi: 10.1016/j.bone.2012.03.023
- Jeon OH, Kim C, Laberge RM, et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nat Med, 2017. doi: 10.1038/nm.4324
- Soul J, Dunn SL, Anand S, et al. Stratification of knee osteoarthritis: two major patient subgroups identified by genome-wide expression analysis of articular cartilage. Ann Rheum Dis, 2018; 77 (3): 423. doi: 10.1136/annrheumdis-2017–212603
- Kurz B, Lemke AK, Fay J, Pufe T, Grodzinsky AJ, Schünke M. Pathomechanisms of cartilage destruction by mechanical injury. Ann Anat, 2005. doi: 10.1016/j.aanat.2005.07.003
- Bhosale AM, Richardson JB. Articular cartilage: structure, injuries and review of management. Br Med Bull, 2008. doi: 10.1093/bmb/ldn025
- Manninen P, Heliövaara M, Riihimäki H, Suomalainen O. Physical workload and the risk of severe knee osteoarthritis. Scand J Work Environ Health, 2002. doi: 10.5271/sjweh.643
- Manninen P. Physical exercise and risk of severe knee osteoarthritis requiring arthroplasty. Baillieres Clin Rheumatol, 2001. doi: 10.1093/rheumatology/40.4.432
- Berenbaum F. Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis!). Osteoarthr Cartil, 2013. doi: 10.1016/j.joca.2012.11.012
- Nehrer S, Ljuhar R, Steindl P, et al. Automated knee osteoarthritis assessment increases physicians’ agreement rate and accuracy: data from the osteoarthritis initiative. Cartilage, 2019. doi: 10.1177/1947603519888793
- Nehrer S. Der Arthrose auf der Spur. Jatros Orthopäd Traumatol Rheumatol, 2016; 6: 73–74
- Hortobágyi T, Westerkamp L, Beam S, et al. Altered hamstring-quadriceps muscle balance in patients with knee osteoarthritis. Clin Biomech, 2005. doi: 10.1016/j.clinbiomech.2004.08.004
- Lewek MD, Rudolph KS, Snyder-Mackler L. Quadriceps femoris muscle weakness and activation failure in patients with symptomatic knee osteoarthritis. J Orthop Res, 2004. doi: 10.1016/S0736-0266(03)00154–2
- Sakakima H, Yoshida Y, Sakae K, Morimoto N. Different frequency treadmill running in immobilization-induced muscle atrophy and ankle joint contracture of rats. Scand J Med Sci Sport, 2004. doi: 10.1111/j.1600–0838.2004.382.x
- Sakakima H, Yoshida Y, Sakae K, Morimoto N. Different frequency treadmill running in immobilization-induced muscle atrophy and ankle joint contracture of rats. Scand J Med Sci Sport, 2004. doi: 10.1111/j.1600–0838.2004.382.x
- Hurley MV, Scott DL, Rees J, Newham DJ. Sensorimotor changes and functional performance in patients with knee osteoarthritis. Ann Rheum Dis, 1997; 56 (11): 641–648. doi: 10.1136/ard.56.11.641
- Hurley MV, Scott DL, Rees J, Newham DJ. Sensorimotor changes and functional performance in patients with knee osteoarthritis. Ann Rheum Dis, 1997; 56 (11): 641–648. doi: 10.1136/ard.56.11.641
- Adams GR, Caiozzo VJ, Baldwin KM. Skeletal muscle unweighting: spaceflight and ground-based models. J Appl Physiol, 2003. doi: 10.1152/japplphysiol.00346.2003
- Appell HJ. Muscular atrophy following immobilisation: a review. Sport Med, 1990. doi: 10.2165/00007256–199010010-00005
- Thompson LV. Skeletal muscle adaptations with age, inactivity, and therapeutic exercise. J Orthop Sport Phys Ther, 2002. doi: 10.2519/jospt.2002.32.2.44
- Amaro A, Amado F, Duarte JA, Appell HJ. Gluteus medius muscle atrophy is related to contralateral and ipsilateral hip joint osteoarthritis. Int J Sports Med, 2007. doi: 10.1055/s‑2007–965078
- Grimaldi A, Richardson C, Stanton W, Durbridge G, Donnelly W, Hides J. The association between degenerative hip joint pathology and size of the gluteus medius, gluteus minimus and piriformis muscles. Man Ther, 2009. doi:10.1016/j.math.2009.07.004
- Ikeda S, Tsumura H, Torisu T. Age-related quadriceps-dominant muscle atrophy and incident radiographic knee osteoarthritis. J Orthop Sci, 2005. doi: 10.1007/s00776-004‑0876‑2
- O’Reilly SC, Jones A, Muir KR, Doherty M. Quadriceps weakness in knee osteoarthritis: the effect on pain and disability. Ann Rheum Dis, 1998. doi: 10.1002/ccd.22386
- Schipplein OD, Andriacchi TP. Interaction between active and passive knee stabilizers during level walking. J Orthop Res, 1991. doi: 10.1002/jor.1100090114
- Slemenda C, Heilman DK, Brandt KD, et al. Reduced quadriceps strength relative to body weight: a risk factor for knee osteoarthritis in women? Arthritis Rheum, 1998. doi:10.1002/1529–0131(199811)41:11<1951::AID-ART9>3.0.CO;2–9
- Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis: report of the European Working Group on Sarcopenia in Older People. Age Ageing, 2010. doi: 10.1093/ageing/afq034
- Goodpaster BH, Park SW, Harris TB, et al. The loss of skeletal muscle strength, mass, and quality in older adults: The Health, Aging and Body Composition Study. J Gerontol A Biol Sci Med Sci, 2006. doi: 10.1093/gerona/61.10.1059
- Janssen I, Baumgartner RN, Ross R, Rosenberg IH, Roubenoff R. Skeletal muscle cutpoints associated with elevated physical disability risk in older men and women. Am J Epidemiol, 2004. doi: 10.1093/aje/kwh058
- Jones TE, Stephenson KW, King JG, Knight KR, Marshall TL, Scott WB. Sarcopenia – mechanisms and treatments. J Getriatr Phys Ther, 2009; 32 (2): 83–89
- Grimby G. Progressive resistance exercise for injury rehabilitation: special emphasis on isokinetic training. Sport Med Int J Appl Med Sci Sport Exerc, 1985. doi: 10.2165/00007256–198502050-00001
- Schäfer M, Dreinhöfer K. Sports and osteoarthrosis. Z Rheumatol, 2009. doi: 10.1007/s00393-009‑0552‑1
- Cymet TC, Sinkov V. Does long-distance running cause osteoarthritis? J Am Osteopat Assoc, 2006; 106 (6): 342–345
- Bosomworth NJ. Exercise and knee osteoarthritis: benefit or hazard? Can Fam Physician, 2009; 55 (9): 871–878
- Urquhart DM, Soufan C, Teichtahl AJ, Wluka AE, Hanna F, Cicuttini FM. Factors that may mediate the relationship between physical activity and the risk for developing knee osteoarthritis. Arthritis Res Ther, 2008. doi: 10.1186/ar2343
- Roddy E, Zhang W, Doherty M, et al. Evidence-based recommendations for the role of exercise in the management of osteoarthritis of the hip or knee – the MOVE concensus. Baillieres Clin Rheumatol, 2005. doi: 10.1093/rheumatology/keh399
- Thomas KS. Home based exercise programme for knee pain and knee osteoarthritis: randomised controlled trial. BMJ, 2002. doi: 10.1136/bmj.325.7367.752
- Roddy E, Zhang W, Doherty M, et al. Evidence-based recommendations for the role of exercise in the management of osteoarthritis of the hip or knee – the MOVE concensus. Baillieres Clin Rheumatol, 2005. doi: 10.1093/rheumatology/keh399
- Thomas KS. Home based exercise programme for knee pain and knee osteoarthritis: randomised controlled trial. BMJ, 2002. doi: 10.1136/bmj.325.7367.752
- Lange AK, Vanwanseele B, Foroughi N, et al. Resistive Exercise for Arthritic Cartilage Health (REACH): a randomized double-blind, sham-exercise controlled trial. BMC Geriatr, 2009. doi: 10.1186/1471–2318‑9–1
- Lange AK, Vanwanseele B, Fiatarone Singh MA. Strength training for treatment of osteoarthritis of the knee: a systematic review. Arthritis Care Res, 2008. doi: 10.1002/art.24118
- Bosomworth NJ. Exercise and knee osteoarthritis: benefit or hazard? Can Fam Physician, 2009; 55 (9): 871–878
- Bennell K, Hinman R. Exercise as a treatment for osteoarthritis. Curr Opin Rheumatol, 2005. doi: 10.1097/01.bor.0000171214.49876.38
- Fraenkel L, Fried T. If you want patients with knee osteoarthritis to exercise, tell them about NSAIDs. Patient Patient Center Outcomes Res, 2008. doi:10.2165/01312067–200801010-00005
- Derry S, Conaghan P, Da Silva JAP, Wiffen PJ, Moore RA. Topical NSAIDs for chronic musculoskeletal pain in adults. Cochrane Database Syst Rev, 2016. doi:10.1002/14651858.CD007400.pub3
- Bauer C, Jeyakumar V, Niculescu-Morzsa E, Kern D, Nehrer S. Hyaluronan thiomer gel/matrix mediated healing of articular cartilage defects in New Zealand White rabbits – a pilot study. J Exp Orthop, 2017. doi:10.1186/s40634-017‑0089‑1
- Meheux CJ, McCulloch PC, Lintner DM, Varner KE, Harris JD. Efficacy of intra-articular platelet-rich plasma injections in knee osteoarthritis: a systematic review. Arthroscopy, 2016. doi: 10.1016/j.arthro.2015.08.005
- Nakazawa F, Matsuno H, Yudoh K, Watanabe Y, Katayama R, Kimura T. Corticosteroid treatment induces chondrocyte apoptosis in an experimental arthritis model in chondrocyte cultures. Clin Exp Rheumatol, 2002; 20 (6): 773–781
- Filardo G, Previtali D, Napoli F, Candrian C, Zaffagnini S, Grassi A. PRP injections for the treatment of knee osteoarthritis: a meta-analysis of randomized controlled trials. Cartilage, 2020. doi: 10.1177/1947603520931170
- Reichenbach S, Sterchi R, Scherer M, et al. Meta-analysis: chondroitin for osteoarthritis of the knee or hip. Ann Intern Med, 2007. doi:10.7326/0003–4819-146–8‑200704170–00009
- Liu X, Machado GC, Eyles JP, Ravi V, Hunter DJ. Dietary supplements for treating osteoarthritis: a systematic review and meta-analysis. Br J Sports Med, 2018. doi: 10.1136/bjsports-2016–097333
- Jin X, Jones G, Cicuttini F, et al. Effect of Vitamin D supplementation on Tibial cartilage volume and knee pain among patients with symptomatic knee osteoarthritis: a randomized clinical trial. JAMA, 2016. doi: 10.1001/jama.2016.1961
- Bruyère O, Reginster JY, Bellamy N, Chapurlat R, Richette P, Cooper C. Clinically meaningful effect of strontium ranelate on symptoms in knee osteoarthritis: a responder analysis. Rheumatology, 2014. doi: 10.1093/rheumatology/keu018