Die Analyse der kinematischen Daten ergab keine signifikanten Unterschiede zwischen den beiden Einlagenbedingungen. Dennoch berichtete ein Großteil der Teilnehmenden eine subjektive Verbesserung der Gangstabilität beim Tragen der sensomotorischen Einlagen. Auf neurophysiologischer Ebene zeigte sich ein leichter Anstieg der Theta-Band-Aktivität, was als Hinweis auf eine verstärkte aufmerksamkeitsgesteuerte Gangkontrolle interpretiert werden kann. Eine signifikante Abnahme der Alpha-Band-Aktivität – ein Marker für eine effizientere sensomotorische Verarbeitung – konnte hingegen nicht nachgewiesen werden.
Diese Ergebnisse deuten darauf hin, dass sensomotorische Einlagen kurzfristig kognitive Aspekte der Gangregulation sowie das subjektive Sicherheitsempfinden positiv beeinflussen könnten, während unmittelbare Veränderungen sensomotorischer Verarbeitungsprozesse und kinematischer Gangmerkmale bei PK-Patienten bislang nicht eindeutig belegt werden konnten. Die begrenzte Stichprobengröße stellt eine wesentliche Einschränkung der Studie dar und limitiert die statistische Aussagekraft der Befunde. Um die potenzielle Wirksamkeit sensomotorischer Einlagen umfassend zu bewerten, sind zukünftige Untersuchungen mit größeren Stichproben sowie Studien, die auch langfristige Effekte und funktionelle Konsequenzen einbeziehen, erforderlich.
Einleitung
Die Parkinson-Erkrankung (PK) zählt zu den häufigsten neurodegenerativen Störungen und geht mit ausgeprägten motorischen Defiziten einher. Besonders das Gangbild ist häufig beeinträchtigt, was sich in einer eingeschränkten Mobilität, einem höheren Sturzrisiko sowie erhöhter Morbidität und Mortalität niederschlägt. Im Vergleich zu gesunden, altersentsprechenden Personen zeigen Menschen mit PK signifikante Abweichungen im Gangmuster, darunter eine verringerte Schrittgeschwindigkeit, kürzere Schrittlänge, veränderte Schrittfrequenz, reduzierte Kopf-Rumpf-Koordination, verkürzte Stützphasendauer und eingeschränktes Armschwingen. Darüber hinaus sind bei Betroffenen sowohl räumliche als auch zeitliche Gangparameter deutlich variabler und asymmetrischer ausgeprägt [1].
Neben diesen kinematischen Auffälligkeiten sind auch funktionelle und strukturelle Veränderungen in Hirnregionen, die mit der Gangkontrolle assoziiert werden, dokumentiert. Im Vergleich zu Jüngeren oder Gesunden vergleichbaren Alters wird bei PK-Patienten eine höhere kortikale Aktivierung während des gewöhnlichen Gehens berichtet. Insbesondere wurde eine verstärkte Aktivierung des präfrontalen Kortex (PFC), der supplementär-motorischen Areale (SMA), des prämotorischen Kortex (PMC) sowie des primär-sensomotorischen Kortex (SMC) beobachtet, was auf eine kompensatorische Inanspruchnahme höherer kortikaler Strukturen hinweist. Die Aktivierung des präfrontalen Kortex konnte zudem mit spezifischen Gangparametern in Zusammenhang gebracht werden [2]. Die Analyse der neuronalen Aktivität erfolgte in den meisten Fällen mittels Elektroenzephalografie (EEG). Veränderungen der EEG-Leistung in niederfrequenten Bändern wurden dabei mit motorischen Dysfunktionen assoziiert.
Typischerweise zeigt sich bei PK-Patienten eine erhöhte Aktivität im Theta-Band (4–7 Hz) sowie eine verstärkte Aktivität im oberen Alpha-Band (10–12 Hz), was auf eine ineffiziente Verarbeitung somatosensorischer Informationen und damit verbundene erhöhte kognitive Beanspruchung – insbesondere im Sinne gesteigerter Aufmerksamkeitsanforderungen – hindeutet [3].
Vor dem Hintergrund dieser veränderten sensomotorischen Informationsverarbeitung ist zudem bekannt, dass viele Menschen mit PK eine reduzierte plantare Fußsensibilität aufweisen, die mit einem erhöhten Sturzrisiko korreliert [4]. Die Mechanorezeptoren der Fußsohle spielen eine zentrale Rolle bei der Rückmeldung sensomotorischer Reize, welche essenziell für Gleichgewichtserhalt und Gangsteuerung sind. Ein vielversprechender Ansatz zur Förderung dieser Rückmeldung stellt der Einsatz von sensorisch stimulierenden Einlagen dar. Diese Einlagen sind mit strukturierten Oberflächen versehen, die eine gezielte Reizung niedrigschwelliger kutaner Rezeptoren ermöglichen [4]. Durch die taktile Stimulation wird eine verbesserte Weiterleitung mechanischer Reize – etwa durch Druck oder Vibration – an das zentrale Nervensystem angestrebt. Daraus ergibt sich die Hypothese, dass eine verbesserte sensomotorische Integration zu einer effektiveren Gleichgewichts- und Gangregulation führen und damit die Gangstabilität erhöhen kann [5].
Während der positive Einfluss stimulierender Einlagen auf kinematische Parameter wie Gehgeschwindigkeit, Schrittlänge, Kadenz und Variabilität in vielen Untersuchungen bestätigt werden konnte [4], konnten andere Arbeiten wiederum keine signifikanten Veränderungen feststellen [6]. Dabei wurden vorwiegend kurzfristige Effekte untersucht, obwohl anzunehmen ist, dass sich lokomotorische Anpassungen eher mittelfristig einstellen. Da sich hingegen neuronale Reaktionen häufig bereits unmittelbar nach Reizsetzung messen lassen, könnte die Kombination kinematischer mit neuronalen Messgrößen einen besseren Zugang zu kurzfristigen Anpassungsvorgänge ermöglichen. Dennoch existieren bislang keine Studien, die kinematische und neurophysiologische Effekte sensorisch stimulierender Einlagen bei PK synchron untersucht haben. Einzig eine Untersuchung von Kenny et al. [7] mit jungen, gesunden Erwachsenen verglich die stimulierenden Einlagen (Stim) mit Placeboeinlagen, allerdings im beidbeinigen Stehen. Die reduzierte zentro-parietale Aktivität im oberen Alpha-Band sowie die verminderten Schwankungen des Körperschwerpunkts sprechen für eine intensivierte sensorische Rückkopplung durch eine taktile Fußsohlenstimulation.
Ziel der vorliegenden Studie war es daher, die Auswirkungen sensomotorisch stimulierender Einlagen auf kinematische und neuronale Parameter bei Parkinson-Patienten zu untersuchen. Die Teilnehmenden führten wiederholt ein standardisiertes Gangparadigma in ihren eigenen Schuhen durch, wobei sie zwei Einlagentypen (Placebo vs. stimulierend) trugen. Zur Minimierung potenzieller Carry-over-Effekte wurde zwischen beiden Bedingungen eine Washout-Phase ohne Einlagen eingefügt.
Im Hinblick auf die neuronalen Messgrößen wurden beim Tragen der stimulierenden Einlagen im Vergleich zu Placebo folgende Veränderungen erwartet:
- Eine Abnahme der EEG-Aktivität im oberen Alpha-Band im zentro-parietalen bzw. okzipitalen Bereich, was auf eine gesteigerte sensomotorische Verarbeitung hindeuten würde.
- Eine Reduktion der Aktivität im Theta-Band im fronto-zentralen Bereich, was als Ausdruck einer verringerten kognitiven Beanspruchung im Sinne eines Aufmerksamkeitsbedarfs interpretiert werden kann.
Darüber hinaus erwarteten wir, dass sich diese kortikalen Veränderungen auch in den kinematischen Gangparametern widerspiegeln würden. Konkret wurde angenommen, dass das Tragen der stimulierenden Einlagen zu folgenden Verbesserungen führt:
- Erhöhung der Ganggeschwindigkeit
- Reduktion der Schrittfrequenz (Kadenz)
- Erhöhung der Schrittlänge
- Verringerung der Schrittlängenvariabilität
Zusätzlich wurde angenommen, dass die stimulierenden Einlagen auch die subjektive Wahrnehmung der eigenen Gangstabilität positiv beeinflussen würden.
Methodik
Es wurden 16 Personen (12 männlich, 4 weiblich) mit idiopathischer Parkinson-Krankheit gemäß den Kriterien der Movement Disorders Society [1] rekrutiert. Das Alter lag zwischen 44 und 73 Jahren (M = 60,25; SD = 8,26). Es bestanden keine höheren kognitiven Defizite (MoCA < 26 [8]). Die Patientinnen und Patienten befanden sich in den Stadien I–II nach Hoehn und Yahr [9] und erzielten Werte zwischen 2 und 43 Punkten im motorischen Teil der UPDRS-Skala (M = 16,25; SD = 11,30). Die Teilnehmenden waren nicht auf Hilfsmittel wie Gehstöcke oder Rollatoren angewiesen. Die Untersuchung fand im medikamentös eingestellten Zustand statt. Die kinematischen Daten konnten von allen Teilnehmenden ausgewertet werden. Aufgrund methodischer bzw. technischer Probleme waren die EEG-Daten nur von 10, und die subjektive Stabilitätseinschätzung war nur von 14 Personen verfügbar.
Die Teilnehmenden führten eine modifizierte Version des Timed-Up-and-Go-Tests (TUG) in selbstgewähltem Tempo über eine Strecke von 18 Metern durch. An deren Wendepunkt musste ein Hindernis im Abstand von 9 Metern umrundet werden. Der Test wurde in randomisierter Reihenfolge in 3 Bedingungen durchgeführt: sensomotorische Einlagen (Stim), nicht sensomotorische Einlagen (Placebo) und als Washout-Bedingung das Gehen mit eigenen Schuhen und Einlagen (Norm). Jede Bedingung bestand aus zehn Durchgängen. Die sensomotorischen Einlagen wurden individuell durch einen lokal ansässigen Orthopädieschuhtechniker auf Basis des Konzepts nach Jahrling gefertigt [10]. Diese enthielten auf einer 3 Millimeter starken EVA-Trägerschicht ein mediales und laterales Rückfußelement, eine retrokapitale Pelotte sowie einen Zehensteg und einen Mikrofaserbezug. Die Placebokondition war letztlich nur die 3‑Millimeter-EVA-Trägerschicht mit identischem Bezugstoff ohne Stimulationswirkung. Nach Abschluss jeder Bedingung bewerteten die Teilnehmenden ihre Gangstabilität auf einer visuellen Analogskala (VAS) zwischen „sehr unsicher“ und „sehr sicher“.
Die Hirnaktivität wurde kontinuierlich mittels mobilem EEG-System mit 32 aktiven Ag/AgCl-Elektroden (Live-Amp, BrainProducts GmbH) aufgezeichnet. Die Elektroden wurden gemäß dem internationalen Standard: dem 10–20-System platziert, wobei der Mittelpunkt zwischen den beiden Processus mastoideus als Referenzpunkt angenommen wurde. Da ein aktives Elektrodensystem verwendet wurde, war ein Impedanzlimit von 10 kOhm ausreichend. Analysiert wurden das obere Alpha-Band (10–12 Hz) und das Theta-Band (4–7 Hz) mithilfe der Software EEGLab (eine Open-Source-Erweiterung für Matlab, Mathworks Inc.), unter Anwendung standardisierter Preprocessing-Pipelines.
Die Ganganalyse erfolgte mit einem markerbasierten, optoelektronischen Motion-Capture-System (32-Kamera-
System Vantage V5/Vero v1.3, Software: Nexus 2.15, Vicon Motion Systems Ltd.). Das verwendete Modell (Plug-in Gait Lower Body) wurde durch zusätzliche Marker an beiden Unterarmen erweitert (insgesamt 24 Marker). Diese wurden mit doppelseitigem Klebeband direkt auf der Haut oder enganliegender Kleidung an anatomisch definierten Punkten angebracht. Die Auswertung erfolgte mittels eigens entwickelter Matlab-Routinen. Analysiert wurden die Parameter: Ganggeschwindigkeit, Schrittfrequenz, Schrittlänge und deren Variabilität.
Zur Hypothesentestung wurden methodenspezifische Auswertungstools verwendet (Matlab R2021, JASP 0.18.3.0). Die Analyse folgte Empfehlungen für zweiarmige Crossover-Designs [11]. Für jede Zielvariable wurden Summen- oder Differenzwerte zwischen erster und letzter verwendeter Einlage berechnet. U‑Tests wurden zur Prüfung von Carryover-Effekten (Summenwerte) und zum Testen von akuten Unterschieden zwischen Placebo und Stim (Differenzwerte) durchgeführt.
Ergebnisse
Gehirnaktivität
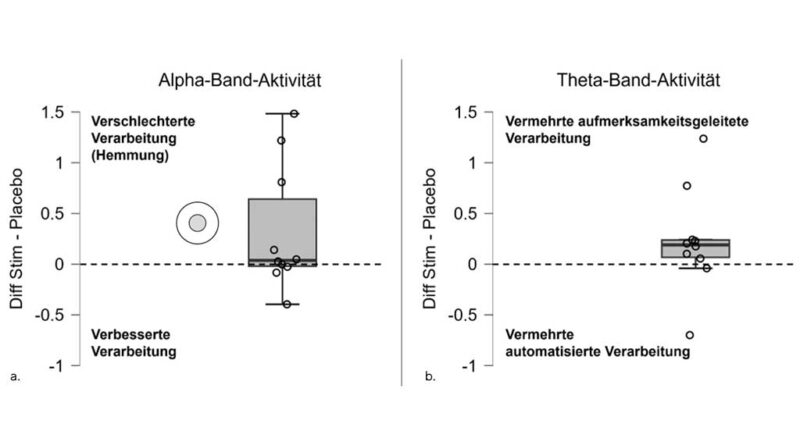
Untersucht wurden zwei spezifische Frequenzbänder der Hirnaktivität, die im Zusammenhang sensomotorischer Regelprozesse stehen – das Alpha- und das Theta-Band. Abbildung 2a zeigt den Vergleich zwischen den sensomotorischen Einlagen (Stim) und den Placeboeinlagen im Alpha-Band. Negative Werte stehen für eine gesteigerte Aktivierung (bessere sensomotorische Verarbeitung), Positive für eine Hemmung. Bei einigen Personen führte das Tragen der Stim-Einlagen tendenziell zu einer Hemmung der sensomotorischen Verarbeitung. Statistisch ließ sich jedoch weder ein positiver noch ein negativer Effekt eindeutig nachweisen (W = 19; p = .171; Rangkorrelation = .583).
Abbildung 2b zeigt die Aufmerksamkeit beim Gehen (ebenfalls Vergleich Stim vs. Placebo). Die meisten Teilnehmenden verwendeten mit den sensomotorischen Einlagen mehr kognitive Ressourcen (positiv), was auf eine weniger automatisierte Gangkontrolle hindeutet. Der Unterschied verfehlte knapp die statistische Signifikanz (W = 21; p = .067; Rangkorrelation = .75).
Kinematik
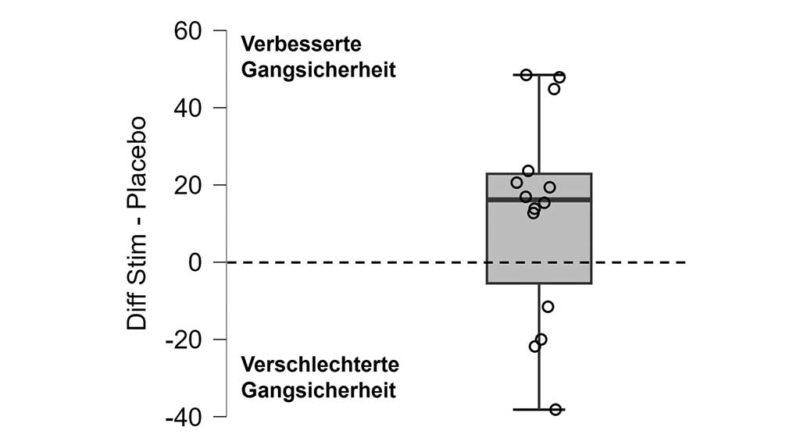
Die Einlagenbedingungen zeigten keine Unterschiede hinsichtlich der Gangparameter. Für keine der analysierten Variablen – Ganggeschwindigkeit (MStim = 1,2; SDStim = 0,2; MPlacebo = 1,2; SDPlacebo = 0,2; in m/s), Schrittfrequenz (MStim = 106,8; SDStim = 7,1; MPlacebo = 107,2; SDPlacebo = 8,0; in Schritten/min), Schrittlänge (MStim = 0,69; SDStim = 0,11; MPlacebo = 0,69; SDPlacebo = 0,11; in m), oder Schrittlängen-Variabilität (MStim = 5,24; SDStim = 1,3; MPlacebo = 5,24; SDPlacebo = 1,4; in %) – ergaben sich signifikante Unterschiede (alle p > .5).
Subjektive Stabilität
Die subjektive Einschätzung der Gangstabilität war unter den Stim-Einlagen tendenziell besser als unter den Placebo-Einlagen. 10 von 14 Teilnehmenden bewerteten das Ganggefühl als sicherer mit den sensomotorischen Einlagen. Auch wenn dieser Effekt nicht signifikant war (W = 37; p = .108; Rangkorrelation = .54), spricht der Trend für einen positiven Einfluss auf das Sicherheitsempfinden.
Diskussion
Soweit ersichtlich, handelt es sich bei der vorliegenden Untersuchung um die erste, die kurzfristige Effekte sensorisch stimulierender Einlagen bei Personen mit Parkinson-Krankheit sowohl auf Ebene der Gangkinematik als auch jener der kortikalen Aktivität betrachtet. Obwohl sich im Hinblick auf objektiv messbare Gangparameter keine signifikanten Veränderungen beim Tragen der stimulierenden Einlagen zeigten, lassen sich dennoch Hinweise auf neuronale Anpassungsvorgänge sowie eine verbesserte subjektive Einschätzung der Gangstabilität erkennen. Die höhere Gangstabilität, die immerhin bei 10 von 14 Teilnehmenden subjektiv empfunden wurde, sowie die gesteigerte Theta-Band-Aktivität, die bei 10 von 12 Teilnehmenden beobachtet wurde, lassen trotz fehlender Signifikanz zumindest beim kurzfristigen Einsatz stimulierender Einlagen einen erhöhten Einsatz aufmerksamkeitslenkender Ressourcen vermuten. Demgegenüber konnten keine Anzeichen für eine verbesserte sensomotorische Integration festgestellt werden, da sich keine signifikante Abnahme der Alpha-Band-Aktivität zeigte. Auch im Bereich der Gangkinematik blieben bedeutende Effekte aus: Weder Gehgeschwindigkeit noch Schrittlänge, Schrittfrequenz oder Variabilität zeigten die erwarteten Veränderungen. Ein möglicher Erklärungsansatz liegt darin, dass sensorisch vermittelte Anpassungen unter Umständen erst nach längerer Expositionszeit bzw. durch wiederholte Nutzung der Einlagen in Alltagskontexten wirksam werden. Künftige Studien sollten daher verstärkt auf langfristige Verläufe fokussieren. Ebenso erscheint es denkbar, dass sich potenzielle Vorteile sensorischer Stimulation vor allem unter unerwarteten oder herausfordernden Bedingungen – etwa bei Stolperereignissen – deutlicher zeigen könnten, also wenn eine schnelle und effektive Rückmeldung über die Fußsohle besonders entscheidend ist [12].
Ein methodischer Schwachpunkt der Studie liegt in der begrenzten Stichprobengröße, die sich unter anderem aus technischen Schwierigkeiten im Studienverlauf ergab und die Aussagekraft der statistischen Analysen einschränkte. Dennoch lässt sich aus dem beobachteten positiven Trend hinsichtlich des subjektiven Sicherheitsempfindens ableiten, dass eine vertiefende Untersuchung mit größerem Stichprobenumfang lohnend erscheint.
Begutachteter Beitrag/reviewed paper
Hinweis:
Dieser Artikel erschien in ähnlicher Form und auf Englisch unter der Lizenz CC BY-NC-ND 4.0 Attribution-NonCommercial-NonDerivatives 4.0 International https://creativecommons.org/licenses/by-nc-nd/4.0/ in dem Fachmagazin Clinical Parkinsonism & Related Disorders 11/2024 veröffentlicht: https://doi.org/10.1016/j.prdoa.2024.100290
Interessenkonflikt:
Der Erstautor ist Geschäftsführer der Footpower Gießen GmbH.
Diese Arbeit wurde gefördert von der Deutschen Forschungsgemeinschaft (DFG, SFB/TRR 135, Projektnummer 222641018).
Für die Autoren:
Dr. Manuel König
footpower Gießen GmbH
Schiffenberger Weg 59
35394 Gießen
Tel: 064197190150
manuel.koenig@giessen.footpower.de
König MM et al. Kurzfristige Effekte sensomotorischer Einlagen auf die Gangsicherheit bei Parkinson-Patienten. Orthopädie Technik, 2025; 76 (10): 48–52
Quellenverzeichnis
[1] Postuma RB et al. MDS clinical diagnostic criteria for Parkinson’s disease. Movement Disorders, 2015; 30 (12): 1591–1601
[2] Maidan I et al. When is higher level cognitive control needed for locomotor tasks among patients with Parkinson’s disease? Brain Topography, 2017; 30 (4): 531–538
[3] Shine JM et al. Abnormal patterns of theta frequency oscillations during the temporal evolution of freezing of gait in Parkinson’s disease. Clinical Neurophysiology, 2014; 125 (3): 569–576
[4] Brognara L, Cauli O. Mechanical plantar foot stimulation in Parkinson’s disease: a scoping review. Diseases, 2020; 8 (2): 12
[5] Nurse MA, Nigg BM. The effect of changes in foot sensation on plantar pressure and muscle activity. Clinical Biomechanics, 2001; 16 (9): 719–727
[6] Alfuth M. Textured and stimulating insoles for balance and gait impairments in patients with multiple sclerosis and Parkinson’s disease: a systematic review and meta-analysis. Gait & Posture, 2017; 51: 132–141
[7] Kenny RPW et al. The effects of textured insoles on cortical activity and quiet bipedal standing with and without vision: an EEG study. Journal of Motor Behavior, 2020; 52 (4): 489–501
[8] Nasreddine ZS et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. Journal of the American Geriatrics Society, 2005; 53 (4): 695–699
[9] Hoehn MM, Yahr MD. Parkinsonism: onset, progression, and mortality. Neurology, 1967; 17 (5): 427–442
[10] Becker S et al. Assessing the subjective effectiveness of sensorimotor insoles (SMIs) in reducing pain: a descriptive multicenter pilot study. Journal of Functional Morphology and Kinesiology, 2023; 8 (2): 66
[11] Wellek S, Blettner M. On the proper use of the crossover design in clinical trials: part 18 of a series on evaluation of scientific publications. Deutsches Ärzteblatt International, 2012; 109 (15): 276–281
[12] Fallon JB, Bent L, McNulty PA, Macefield VG. Evidence for strong synaptic coupling between single tactile afferents from the sole of the foot and motoneurons supplying leg muscles. Journal of Neurophysiology, 2005; 94 (6): 3795–3804
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 11. Februar 2026