Einleitung
Mikroprozessorgesteuerte Kniegelenke (MPK) haben durch ihre situationsabhängige Anpassung der Bewegungswiderstände in Stand- und Schwungphase einen festen Platz in der prothetischen Versorgung transfemoral Amputierter. Jedoch kann die Mikroprozessorsteuerung allein kein Gütesiegel für ein hochwertiges Kniegelenk sein. Erst die Kombination aus komplexer Sensorik, intelligenten Algorithmen und leistungsfähigen Aktuatoren bestimmt die Qualität eines Gelenkes und hat direkten Einfluss auf Patientennutzen 1 2 3 4 5 6 7 8 und Patientensicherheit 9 10 11 12 13 14 15 16. Bei den verschiedenen am Markt befindlichen Systemen ergibt sich für den Orthopädie-Techniker zwangsläufig die Frage, welches MPK für die individuellen Anforderungen eines Patienten am besten geeignet ist. In der vorliegenden Studie wurden die vier MPK C‑Leg, Orion, Plié2.0 und Rel‑K untersucht, um einen Zusammenhang zwischen technischem Design der Gelenke und ihrer Leistungsfähigkeit im Ganglabor herzustellen.
Material und Methode
Es wurden die Kniegelenke C‑Leg (Otto Bock Healthcare [a]), Orion (Chas A Blatchford and Sons [b]), Plié2.0 (Freedom Innovations [c]) und Rel‑K (Rizzoli Ortopedia [d]) in Kombination mit einem 1C60 [a] Prothesenfuß und dem gewohnten Schaft in sitzbeinumgreifendem Design verwendet.
Die Messungen fanden in einem Ganglabor mit einer instrumentierten, 12 m langen Gehstrecke statt. Die Kinematik der Körpersegmente wurde mit einem optischen Ganganalysesystem (Vicon 460 [e]) erfasst. Die kinetischen Daten wurden mit zwei im Boden eingelassenen Kraftmessplatten (Kistler 9287A [f]) und simultan mit dem im Prothesenaufbau integrierten Kraft- und Momentensensor Oktapod [a] gemessen 17.
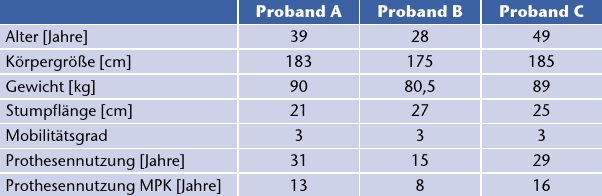
Drei unilateral transfemoral amputierte männliche Probanden nahmen an der Studie teil (Tab. 1). Alle Probanden nutzen ein Genium MPK [a] im Alltag und hatten Erfahrung mit den untersuchten Kniegelenken aus früheren Ganglabortests. Dadurch konnte eine kurze Eingewöhnungszeit realisiert und zusätzlich die Vergleichbarkeit der Ergebnisse sichergestellt werden.
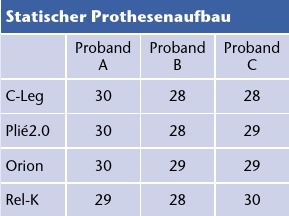
Um die Unterschiede zwischen den MPK hervorzuheben, erstellte ein Orthopädie-Techniker mithilfe des LASAR Assembly [a] identische Prothesenaufbauten für jedes Kniegelenk. Dabei wurden die Vorgaben der jeweiligen Hersteller zum Aufbau eingehalten. Daraufhin folgte die Optimierung des statischen Aufbaus mit dem LASAR Posture [a] nach Empfehlungen von Otto Bock Healthcare (Tab. 2). Die Softwareparameter der Kniegelenke wurden vom Orthopädie-Techniker anschließend nach Herstellerangaben individuell angepasst, um ein bestmögliches Gehen bei allen Geschwindigkeiten zu gewährleisten. Daraufhin konnten sich die Probanden wenigstens 30 Minuten an das Gehen mit der jeweiligen Prothese gewöhnen.
Die Probanden absolvierten mit jedem Kniegelenk vier Versuchsreihen mit 8 bis 10 Wiederholungen. Dabei wurden sie angewiesen, in selbstgewählter mittlerer, langsamer und schneller Geschwindigkeit sowie in mittlerer Geschwindigkeit mit bewusster Standphasenflexion zu gehen. In Tabelle 3 sind die gemessenen Geschwindigkeiten aufgeführt. Die Reihenfolge der MPK wurde randomisiert.
Für die kontinuierlich aufgezeichneten Daten des mobilen Messsystems wurden eine automatische Schritterkennung sowie ein automatischer Schrittfilter verwendet. Dadurch konnten Abbrems- und Beschleunigungsvorgänge entfernt werden. Für jeden identifizierten Schritt wurden Parameter für die statistische Auswertung bestimmt.
Die Hypothesentestung für einzelne Parameter erfolgte bei einem Signifikanzniveau von 5 % mit Kolmogorov-Smirnov-Tests sowie mit mehrfaktoriellen Varianzanalysen (ANOVA) und Bonferroni-Korrektur im Posthoc-Test 18.
Eine abschließende technische Analyse sollte die im Ganglabor identifizierten Differenzen in der Leistungsfähigkeit der MPK erklären. Dazu wurden Patente und die Angaben des Herstellers wie Bedienungsanleitungen, Aufbauempfehlungen und Werbematerial ausgewertet 19 20 21 22 23 24. Zum Abschluss wurde mit einem für die Materialforschung entwickelten Computertomographen ein 3‑D-Datensatz jedes Kniegelenks aufgenommen. Die Kombination aus 450kV- Hochenergie-Röntgenröhre und 1024×1024 Pixel-Flachbilddetektor ermöglichte dabei eine Auflösung von 0,5 mm in allen Raumrichtungen.
Ergebnisse im Ganglabor
Zeit-Distanz-Parameter
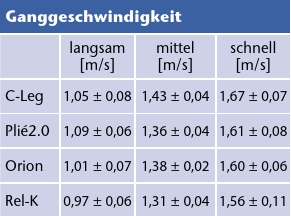
Die drei selbstgewählten Geschwindigkeiten (langsam, mittel, schnell) unterschieden sich zwischen den Probanden und sind in Tabelle 3 dargestellt. Alle Probanden tendierten dazu, am schnellsten mit dem C‑Leg und am langsamsten mit dem Rel‑K zu gehen. Dies wird auch in Abbildung 1 deutlich, die den gewichteten Mittelwert und das Konfidenzintervall der Ganggeschwindigkeit für die einzelnen Kniegelenke angibt. So finden sich jeweils signifikante Unterschiede zwischen Rel‑K und allen anderen Kniegelenken, da sich die Konfidenzintervalle nicht überlappen. Zwischen C‑Leg und Plié2.0 sowie zwischen Orion und Plié2.0 besteht dementsprechend kein signifikanter Unterschied.
Die Gangsymmetrie wurde anhand der Standphasendauer auf amputierter und kontralateraler Seite bestimmt. Die Verkürzung der Standphase auf der amputierten Seite lag im Mittel bei 3,93 ± 9,74 % des Gangzyklus. Dabei konnten keine signifikanten Unterschiede zwischen den Probanden und zwischen den Gelenken festgestellt werden.
Schwungphase
In Abbildung 2 ist das Maximum des Knieflexionswinkels über der Ganggeschwindigkeit für amputierte und kontralaterale Seite dargestellt. Neben allen einzelnen Werten ist zusätzlich die Regressionsgerade eingefügt. Der Anstieg des Kniewinkelmaximums mit der Ganggeschwindigkeit beträgt bei C‑Leg 3,5°/m/s, bei Plié2.0 28,1°/m/s, bei Orion 18,3°/m/s und bei Rel‑K 17°/m/s. Auf der kontralateralen Seite ist der Anstieg mit allen MPK ähnlich und beträgt im Mittel 6,2°/m/s. Das geringe Bestimmtheitsmaß (R2 < 0,1) in Tabelle 4 unterstreicht, dass ein starker Anstieg des Kniewinkelmaximums mit der Ganggeschwindigkeit unnatürlich ist. Beim C‑Leg konnte also die beste Annäherung an das Verhalten des natürlichen Vorbilds erreicht werden.
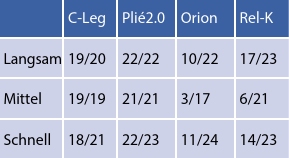
In der terminalen Schwungphase muss die Kniestreckung vollständig erfolgen, um den Bodenkontakt des Fußes vorzubereiten. Unabhängig vom letztendlich erreichten Gelenkwinkel (Abb. 3) lässt sich am Streckanschlag ein Nulldurchgang in der Kniewinkelgeschwindigkeit detektieren. Deshalb wurden die Nulldurchgänge zwischen 80 und 100 % Gangzyklus gezählt und zu allen aufgenommenen Schritten ins Verhältnis gesetzt. Aus Tabelle 5 lässt sich entnehmen, dass mit Plié2.0 und C‑Leg der Streckanschlag bei allen Geschwindigkeiten sicher erreicht wird. Im Gegensatz dazu finden sich in der mittleren Geschwindigkeit bei Rel‑K und Orion häufiger unvollständige Kniestreckungen. Um die Auswirkungen auf die Fußpositionierung abzuschätzen, wurde die Kniewinkelgeschwindigkeit kurz vor dem Auftreten bestimmt und in Abbildung 4 dargestellt. Das Plié2.0 zeigte hier die geringsten, teils negativen Werte ohne signifikante Unterschiede zum C‑Leg. Signifikante Unterschiede bestehen zum Orion und zum Rel‑K. Das Rel‑K erzeugte die höchste Kniewinkelgeschwindigkeit vor dem Auftreten.
Standphasenflexion
Die Versuchsreihe mit bewusster Standphasenflexion wurde zur Bewertung der Standphasenextensionsdämpfung herangezogen. Eine harmonische Dämpfung sollte sich in einem gleichmäßigen Kniewinkelverlauf widerspiegeln (Abb. 5, links). Dieser wird wiederum durch geringe Kniewinkelbeschleunigungen angezeigt (Abb. 5, rechts), deren Minima in Abbildung 6 ausgewertet wurden. C‑Leg (-2565 ± 1431°/s2) und Orion (-3149 ± 1014°/s2) zeigten die kleinsten Werte und damit das gleichmäßigste Dämpfungsverhalten. Im Vergleich zu Plié2.0 (-4347 ± 1181°/s2) und Rel‑K (-7042 ± 2200°/s2) konnten signifikante Unterschiede festgestellt werden. Während der Versuchsreihen mit dem Rel‑K führte die bewusste Standphasenflexion jedes Mal dazu, dass die folgende Schwungphase nicht eingeleitet werden konnte. Das Rel‑K blieb gestreckt und unterbrach damit die Fortbewegung. Die Unterschiede zwischen den Minima in Abbildung 5 und in der statistischen Auswertung sind im Übrigen durch die punktweise Berechnung der Mittelwertkurven bedingt. Diese verändert die Größe der Maxima und Minima, die Kurvencharakteristik bleibt aber erhalten.
Einleitung der Schwungphase
Mithilfe des externen Hüftmoments lässt sich die körperliche Beanspruchung zur Einleitung der Schwungphase bewerten. Das aufzubringende Hüftmoment ist jedoch stark von der Ganggeschwindigkeit abhängig (R2 > 0,5 für alle MPK und Probanden), weshalb im Folgenden nur die mittlere Geschwindigkeit betrachtet werden soll. Um dennoch eine ausreichende Anzahl an Schritten zur Verfügung zu haben, wurden die Daten des im Prothesenaufbau integrierten Messsystems Oktapod verwendet. In Abbildung 7 ist das Minimum des notwendigen Hüftmoments zur Schwungphaseneinleitung dargestellt. Beim Plié2.0 zeigten sich die höchsten absoluten Werte (-95.2 ± 9.5 Nm). Danach folgen Orion (-93.8 ± 10.2 Nm), Rel‑K (-90.7 ± 12.5 Nm) und C‑Leg (-88.7 ± 4.7 Nm) mit signifikant geringeren Werten.
Ergebnisse der technischen Analyse
Funktionsprinzip C‑Leg
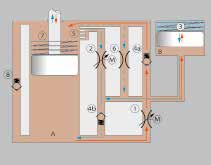
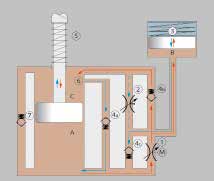
Beim C‑Leg wird der Gelenkwiderstand durch zwei mikroprozessorgesteuerte servohydraulische Ventile erzeugt. So kann der Widerstand stufenlos und unabhängig für die Flexions- und Extensionsrichtung eingestellt und situationsabhängig angepasst werden. In Abbildung 8 ist zu erkennen, dass die Abwärtsbewegung des Kolbens während der Flexion einen Ölfluss (rot) von Kammer A über das servohydraulische Flexionsventil 1 und das Rückschlagventil 4a verursacht. Die Kolbenstange verdrängt außerdem Öl, das in den Ausgleichsbehälter gelangt und dort die Stahlfeder 3 komprimiert. Während der folgenden Extensionsbewegung (blau) wird die dort gespeicherte Energie wieder abgegeben. Die Aufwärtsbewegung des Kolbens führt weiterhin zu einem Ölfluss über das servohydraulische Extensionsventil 2 und das Rückschlagventil 4b. Mit zunehmender Extension wird der Zufluss des Strömungspfads 5 durch den Kolben verlegt. Dadurch ergibt sich eine progressive Endanschlagsdämpfung, die durch die Stahlfeder 7 unterstützt wird. Das Überdruckventil 8 verhindert die Überlastung des Kniegelenks in Flexionsrichtung. Durch das Sicherheitsventil 6 ist auch bei leerem Akku eine langsame Extension des Gelenks möglich.
Funktionsprinzip Plié2.0
Beim Plié2.0 wird der Gelenkwiderstand durch ein mikroprozessorgesteuertes Nadelventil (offen/geschlossen) und zwei manuell einstellbare Ventile erzeugt. So kann für die Flexionsrichtung zwischen einem hohen Standphasen- und einem niedrigen Schwungphasenwiderstand umgeschaltet werden. Für die Extensionsrichtung kann ein Widerstand manuell voreingestellt werden.
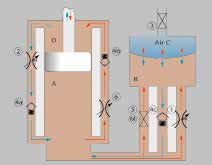
Während der Flexion (Abb. 9, rot) bewegt sich der Kolben abwärts, und das durch die einfahrende Kolbenstange verdrängte Öl gelangt in Kammer B und komprimiert die Luftdruckfeder C. Bei geschlossenem Nadelventil 5 strömt das Öl dabei nur durch das manuell einstellbare Ventil 1 mit hohem Widerstand. Ist das aktive Nadelventil 5 offen, verursacht dessen weit größerer Querschnitt einen geringen Gelenkwiderstand für die Schwungphasenflexion. Während der Flexion wird außerdem das Rückschlagventil 4b durchströmt, dessen Widerstand druckabhängig ist (in Abb. 9 durch Ventil 6 illustriert) und somit ebenfalls keine mikroprozessorgesteuerte Widerstandsanpassung ermöglicht.
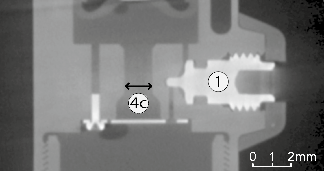
Während der Extension (blau) wird die in Luftdruckfeder C gespeicherte Energie wieder abgegeben. Dabei strömt das Öl durch das großvolumige Rückschlagventil 4c. Das aktive Ventil 5 hat dadurch keinen Einfluss auf den Extensionswiderstand. Dies wird auch aus Abbildung 10 ersichtlich, in der die Ventilquerschnitte von Ventil 1, 4c und 5 gezeigt sind. Während der Extension strömt weiterhin Öl von Kammer D durch das manuell einstellbare Ventil 2 und das Rückschlagventil 4a in Richtung A. Hieraus ergibt sich der Extensionswiderstand, der ebenfalls nicht vom Mikroprozessor angepasst werden kann. Wird eine Handluftpumpe an Ventil 3 geschlossen, kann der Druck in der Luftfeder und damit die Extensionsunterstützung angepasst werden. Dies ändert ebenfalls den Flexionswiderstand, was sich besonders auf die Schwungphase auswirkt.
Funktionsprinzip Orion
Die Gelenkwiderstände des Orion werden durch ein mikroprozessorgesteuertes servohydraulisches Ventil, ein mikroprozessorgesteuertes pneumatisches Ventil und ein manuell einstellbares Ventil erzeugt. Durch den Mikroprozessor kann damit der Flexionswiderstand stufenlos reguliert und die Extensionsunterstützung für den folgenden Schritt angepasst werden.
Das hydraulische und das pneumatische System sind über eine gemeinsame Kolbenstange verbunden. Während der Flexion (Abb. 11, rot) fließt Öl von Kammer A über das servohydraulische Ventil 1 und das Rückschlagventil 4a zu Kammer B. Weiterhin strömt Luft aus Kammer C über Rückschlagventil 4c und das aktive quasikontinuierlich arbeitende Nadelventil 3 zu Kammer D. Der Flexionswiderstand lässt sich also in beiden Kreisen vom Mikroprozessor verändern. Wird Ventil 3 zunehmend geschlossen, so wirkt der Pneumatikkolben eher als Luftfeder, indem der Druck in Kammer C erhöht und in Kammer D verringert wird. Die so gespeicherte Energie wird während der folgenden Extensionsbewegung (blau) wieder abgegeben. Dabei gleicht sich der Druck in Kammer C und D wieder an. Bei weiterer Extension wird der Druckanstieg in D über das Rückschlagventil 4d ausgeglichen. Der Extensionswiderstand wird deshalb hauptsächlich durch den Hydraulikkreis definiert. Hier strömt das Öl bei Extension durch das Rückschlagventil 4b und das manuell einstellbare Ventil 2. Die progressive Dämpfung des Extensionsanschlags wird durch die Verlegung des Zuflusses 5 mit dem Kolben realisiert. Der Mikroprozessor kann damit den Extensionswiderstand nicht direkt beeinflussen, sondern passt nur die Extensionsunterstützung an.
Funktionsprinzip Rel‑K
Das Rel‑K besitzt ein mikroprozessorgesteuertes servohydraulisches Ventil und ein manuell einstellbares Ventil zur Erzeugung der Gelenkwiderstände. Damit lässt sich der Flexionswiderstand durch den Mikroprozessor stufenlos regulieren. In Extensionsrichtung kann allein die Endanschlagsdämpfung manuell angepasst werden.
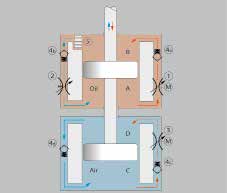
Während der Flexion des Gelenks (Abb. 12, rot) bewegt sich der Kolben abwärts und verursacht einen Ölfluss von Kammer A über das servohydraulische Flexionsventil 1 und das Rückschlagventil 4b zu Kammer C. Das durch die Kolbenstange verdrängte Ölvolumen komprimiert dabei die Feder 3 im Ausgleichsbehälter B. Weiterhin spannt sich die um die Kolbenstange angeordnete Stahlfeder bei der Flexion. Während der Extension (blau) wird die in den Stahlfedern 3 und 5 gespeicherte Energie abgegeben. Dabei ergibt sich ein Ölfluss von Kammer B über Rückschlagventil 4c nach Kammer A. Das aktive Ventil 1 wird dabei wegen des geringeren Ventilquerschnitts umgangen. Gleichzeitig strömt Öl von Kammer C über Rückschlagventil 4a nach Kammer A. Die Extensionsdämpfung wird also nur durch den internen Gelenkwiderstand definiert. Mit zunehmender Extension wird der Zufluss des Strömungspfads 6 durch den Kolben verlegt, und der geringe Querschnitt des manuell einstellbaren Ventils 2 kommt zum Tragen. Dadurch steigt der Extensionswiderstand abrupt an, da keine Elemente vorhanden sind, die eine progressive Dämpfung ermöglichen. Das Sicherheitsventil 7 schützt die Hydraulik vor Überlastung in Flexionsrichtung.
Diskussion
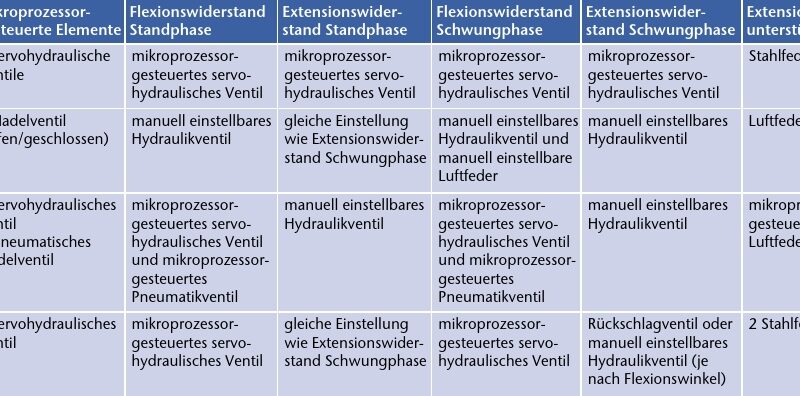
Verglichen mit konventionellen mechanischen Kniegelenken kann durch die Mikroprozessorsteuerung eine hohe Verlässlichkeit beim Wechsel zwischen Stand- und Schwungphase erreicht werden. Außerdem lässt sich mit einigen Gelenken der Widerstand nicht nur für die jeweilige Gangphase einstellen – es sind auch graduelle Anpassungen möglich, die die Erfordernisse unterschiedlicher Bewegungen und Gangsituationen berücksichtigen (Tab. 6).
Bedingt durch den veränderten Muskelstatus und die sensorischen Defizite der amputierten Seite ließ sich dennoch für alle untersuchten MPK eine Asymmetrie in der Standphasendauer feststellen. Die hier gemessene Verkürzung der Standphase auf der amputierten Seite von 3,93 ± 9,74 % konnte auch in anderen Studien gezeigt werden und lässt keinen Rückschluss auf die Qualität der MPK zu 25 26. Auch die selbstgewählte Ganggeschwindigkeit ist kein geeignetes Kriterium für die Bewertung der MPK. Hier konnten signifikante Unterschiede zwischen den Gelenken festgestellt werden. Im Mittel liefen alle Probanden mit dem C‑Leg am schnellsten und mit dem Rel‑K am langsamsten (p < 0.0001). Da die Geschwindigkeit einen starken Effekt auf weitere Gangparameter hat, wurde in der Datenauswertung stets geprüft, ob ihr Einfluss die Ergebnisse überlagert. Die höhere Dynamik bei großen Ganggeschwindigkeiten, wie sie mit C‑Leg, Plié2.0 und Orion erzielt wurden, erfordert beispielweise eine adäquate Dämpfung der Lastübernahme beim Auftreten.
Auf der kontralateralen Seite erfolgt zu diesem Zweck eine ausgeprägte Standphasenflexion. Auch bei gesunden Probanden erfolgt diese und verringert die Amplitude des Körperschwerpunkts. Dennoch wird der Patientennutzen der Standphasenflexion kontrovers diskutiert, obwohl auch das Gangbild natürlicher erscheint. Als gesichert gilt, dass die Zeit zwischen Fersenauftritt und Bodenkontakt des Vorfußes verkürzt werden kann 27. Der dadurch längere vollflächige Bodenkontakt könnte die Stabilität verbessern.
Prothesenkniegelenke, die eine Standphasenflexion ermöglichen, müssen nicht nur die Flexions‑, sondern auch die Extensionsbewegung dämpfen, um abrupte Bewegungen zu vermeiden. Die am Streckanschlag gemessene Winkelbeschleunigung zeigte, dass Rel‑K und Plié2.0 keine adäquate Dämpfung der Standphasenextension ermöglichen. Weiterhin war es mit dem Rel‑K nicht möglich, nach der Standphasenflexion die folgende Schwungphase einzuleiten. Der Flexionswiderstand blieb jedes Mal so hoch, dass kein normaler Schritt mehr möglich war. Da sich aus der Analyse des technischen Designs kein Anhaltspunkt für dieses Verhalten ergab, sind die Steuerungsalgorithmen des Rel‑K wahrscheinlich hierfür verantwortlich. Durch die stärkere Dämpfung des Streckanschlags bieten C‑Leg und Orion eine bessere Unterstützung der Standphasenflexion. Die technische Analyse bestätigte, dass der Extensionswiderstand bei Plié2.0 und Rel‑K nicht vom Mikroprozessor beeinflusst werden kann und deshalb nur die Anforderungen für die Schwungphasenextension erfüllt. Obwohl das Orion den Extensionswiderstand des Hydraulikkreises ebenfalls nicht mikroprozessorgesteuert anpassen kann, führt wahrscheinlich der progressive Streckanschlag zu einem günstigen Verhalten für die Extension während der Standphase.
Noch während der Standphase wird die folgende Schwungphase eingeleitet. Dazu müssen transfemoral Amputierte mit den Hüftflexoren das natürliche Hüftgelenk und das prothetische Kniegelenk beugen. Deshalb sollte der muskuläre Aufwand zum Einleiten der Schwungphase möglichst gering sein. Das externe Hüftmoment während der Schwungphaseneinleitung kann als Indikator für die Aktivität der verbliebenen Hüftmuskulatur genutzt werden. Schmalz et al. brachten außerdem erhöhte Hüftflexionsmomente mit einer Steigerung des metabolischen Energieverbrauchs in Zusammenhang 28.
Das bei Schwungphaseneinleitung gemessene Hüftmoment lässt vermuten, dass mit dem C‑Leg der geringste muskuläre Aufwand zur Beugungseinleitung erforderlich ist. Dass die Beugungseinleitung mit dem Plié2.0 im direkten Vergleich zum C‑Leg einfacher erfolgt, konnte somit nicht bestätigt werden 29 .
Da der statische Prothesenaufbau und damit das externe Kniemoment für jedes Kniegelenk identisch war, könnten die gemessenen Differenzen im Hüftmoment auf den Flexionswiderstand der Gelenke schließen lassen. Die technische Analyse zeigte, dass der minimale Widerstand bei geöffnetem Flexionsventil hauptsächlich durch die Extensionsunterstützung gegeben ist. Daraus folgt, dass diese neben dem verlässlichen Erreichen des Streckanschlags auch einen geringen Flexionswiderstand gewährleisten muss.
Der bei den meisten MPK anzutreffende Hauptvorteil ist die Adaption des Flexionswiderstandes in der Schwungphase an die Erfordernisse verschiedener Ganggeschwindigkeiten. Andernfalls muss der Knieflexionswinkel durch eine aktive Ausgleichsbewegung korrigiert werden, da auch beim Geschwindigkeitswechsel eine ausreichende Bodenfreiheit und ein verlässliches Erreichen des Streckanschlages gewährleistet sein muss.
Verschiedene Studien mit gesunden Probanden zeigten, dass der lineare Zusammenhang zwischen maximalem Flexionswinkel und Ganggeschwindigkeit nicht 30 31 oder mit R2 um 0,4 nur geringfügig 32 33 ausgeprägt ist. Die Messwerte der kontralateralen Seite bestätigen dies für alle MPK (6,2°/m/s). Das C‑Leg kommt dem natürlichen Verhalten am nächsten, da sich das Knieflexionswinkelmaximum mit nur 3,2°/m/s ändert. Die erheblich höheren Messwerte von Orion (17,0°/m/s) und von Rel‑K (18,3°/m/s) liegen in einem Bereich, der auch bei anderen MPK festgestellt wurde 34. Die starke Abhängigkeit des Knieflexionswinkels von der Ganggeschwindigkeit beim Plié2.0 von 28,1°/m/s übersteigt die Werte der anderen MPK deutlich. Damit kann das Plié2.0 die Anforderungen an ein natürliches Schwungphasenverhalten nicht erfüllen. Die technische Analyse bestätigte, dass die Flexionsdämpfung beim Plié2.0 durch den Mikroprozessor nicht an verschiedene Ganggeschwindigkeiten angepasst werden kann.
Die folgende Schwungphasenextension ist ein weiteres wichtiges Qualitätskriterium für MPK, da damit das verlässliche Erreichen des Streckanschlages und eine genaue Fußpositionierung beim Fersenauftritt gewährleistet werden. Bei gesunden Probanden wird der Streckanschlag bei rund 97 % des Gangzyklus erreicht. Dieses Kriterium wurde bei allen Geschwindigkeiten vom Plié2.0 und vom C‑Leg am besten erfüllt. Die größte Bewegung im Gelenk kurz vor Fersenkontakt wurde beim Rel‑K gemessen. Das Orion zeigte ebenfalls eine erhöhte Winkelgeschwindigkeit unmittelbar vor dem Auftreten. Dennoch konnten mit beiden MPK keine Unsicherheiten während der Messungen beobachtet werden. Allerdings erfordert der ebene Boden des Ganglabors keine hohe Präzision bei der Positionierung des Fußes, die aber beim Gehen von Treppen und Rampen notwendig wäre.
Limitationen der Studie
Die geringe Anzahl und die Auswahl von Probanden hohen Mobilitätsgrades stellen die wesentlichen Limitationen dieser Studie dar. Ebenfalls kann die beobachtete Situation im Labor Einfluss auf die Ergebnisse haben. Da nur ausgewählte Parameter mit dem mobilen Messsystem erfasst werden können, waren umfassende Feldmessungen nicht möglich. Es konnte jedoch gezeigt werden, dass die Auswirkungen der genannten Einschränkungen gering blieben, da in der technischen Analyse die Ergebnisse der Ganglabormessungen bestätigt werden konnten. Durch die vergleichbare Eingewöhnungszeit vor Beginn der Messungen wurde versucht, restriktive Effekte zu vermeiden. Weiterhin sollte die Bewertung des Ganges bei allen Geschwindigkeiten durch Orthopädie-Techniker und Proband eventuelle Effekte durch die Einstellung der Kniegelenksparameter reduzieren. Das zumeist verlässliche Erreichen des Streckanschlages bei schneller und langsamer Ganggeschwindigkeit unterstreicht, dass ein akzeptabler Kompromiss gefunden wurde. Es wäre außerdem wünschenswert, die aus den gezeigten Differenzen bei sicherheitsrelevanten Merkmalen resultierende Sturzneigung näher zu untersuchen. Dazu könnte in Zukunft der am Fachgebiet Medizintechnik entwickelte Gangsimulator 35 verwendet werden, um die mit Sturzsituationen einhergehende Probandenbelastung zu vermeiden.
Zusammenfassung
Bei den in dieser Studie untersuchten mikroprozessorgesteuerten Kniegelenken (C‑Leg, Plié2.0, Orion und Rel‑K) konnten signifikante Qualitätsunterschiede beim ebenen Gehen im Ganglabor festgestellt werden. Die technischen Analysen zeigten, dass diese Unterschiede auf die verschiedenen Funktionsprinzipien zurückgeführt werden können. Die Standphasensteuerung ist eine zentrale Funktion der MPK. Beim Gehen mit Standphasenflexion wird ein natürlicheres Gangbild erreicht, und der vollflächige Bodenkontakt des Fußes erfolgt schneller. Die Analyse der Kniewinkelbeschleunigung zeigte, dass mit C‑Leg und Orion eine harmonischere Dämpfung des Extensionsanschlages nach Standphasenflexion erreicht wird. Der Streckanschlag von Plié2.0 und Rel‑K war signifikant schlechter gedämpft. In der technischen Analyse zeigte sich, dass das C‑Leg den Extensionswiderstand mit einem mikroprozessorgesteuerten Ventil anpasst. Das Orion besitzt eine konstruktiv festgelegte progressive Dämpfung. Bei Plié2.0 und Rel‑K konnten keine Elemente identifiziert werden, die eine adäquate Dämpfung der Standphasenextension ermöglichen würden. Das Rel‑K erlaubte außerdem kein fortlaufendes Gehen mit Standphasenflexion.
Aus den externen Hüftmomenten, die durch die verbliebenen Hüftflexoren aufgebracht werden müssen, ließ sich auf die Einleitung der Schwungphase schließen. Diese war für alle Ganggeschwindigkeiten mit dem C‑Leg am leichtesten.
Das folgende Maximum des Knieflexionswinkels variierte bei unterschiedlichen Ganggeschwindigkeiten mit dem C‑Leg am geringsten, was dem Verhalten der kontralateralen Seite am nächsten kam. Die verlässliche Steuerung des Flexionswinkels bei variabler Kadenz ist eine Voraussetzung zur Vermeidung von Stolpersituationen durch den Bodenkontakt der Zehenspitze beim Durchschwingen oder durch schlechtes Timing beim Erreichen des Streckanschlages.
Bei Orion und Rel‑K konnte ein starker Zusammenhang zwischen Kniewinkelmaximum und Ganggeschwindigkeit nachgewiesen werden. Plié2.0 wich am stärksten von einer optimalen Schwungphasensteuerung ab. Die technische Analyse bestätigte, dass beim Plié2.0 keine mikroprozessorgesteuerte Adaption des Flexionswiderstandes möglich ist. Es kann nur zwischen einem hohen Standphasenflexionswiderstand und einem niedrigen Schwungphasenflexionswiderstand umgeschaltet werden. Dadurch lässt sich die starke Zunahme des Knieflexionswinkels mit der Ganggeschwindigkeit erklären. Im Gegensatz dazu weisen C‑Leg, Orion und Rel‑K servohydraulische Ventile zur mikroprozessorgesteuerten Adaption des Flexionswiderstandes auf.
In der folgenden Schwungphasenextension wurde bei allen Geschwindigkeiten mit dem Plié2.0 wie auch mit dem C‑Leg der Streckanschlag vor dem Fersenauftritt erreicht. Speziell bei mittlerer Geschwindigkeit war dies beim Orion und Rel‑K seltener der Fall, was die Positioniergenauigkeit des Fußes verringern könnte.
Die ermittelten signifikanten Unterschiede in der Funktion der Kniegelenke lassen vermuten, dass der tatsächliche Patientennutzen ebenfalls stark variiert. Es wäre weiterhin denkbar, dass in besonders sicherheitskritischen Gangsituationen wie auf unebenem Terrain, Treppen oder Rampen diese Unterschiede noch deutlicher zutage treten. Deshalb kann nicht davon ausgegangen werden, dass die klinischen Ergebnisse einzelner MPK auf andere Gelenke übertragen werden können. Es besteht weiterer Forschungsbedarf, um die verschiedenen Funktionalitäten und sicherheitsrelevanten Merkmale umfassender zu beleuchten.
Danksagung
Die Autoren bedanken sich bei der Bundesanstalt für Materialprüfung (BAM) für die Bereitstellung der Computertomographien der MPK sowie bei Saeed Zahedi (Blatchford and Son) für die Anmerkungen zum Funktionsprinzip des Orion und bei Philipp Kampas (Otto Bock Healthcare) für die Erläuterungen zum C‑Leg.
Interessenskonflikt
Diese Studie wurde durch den Hersteller des C‑Leg Otto Bock Healthcare GmbH finanziert.
Originalfassung
Dieser Artikel ist bereits in einer ungekürzten englischen Fassung erschienen: Thiele J, Westebbe B, Bellmann M, Kraft M. Designs and performance of microprocessor-controlled knee joints. Biomedizinische Technik/Biomedical Engineering, 2014; 59 (1): 65–77, ISSN 0013–5585, DOI: 10.1515/ bmt-2013–0069
Für die Autoren:
Julius Thiele
Technische Universität Berlin
Fachgebiet Medizintechnik
Dovestraße 6
10587 Berlin
julius.thiele@tu-berlin.de
Begutachteter Beitrag/Reviewed paper
Thiele J, Westebbe B, Bellmann M, Kraft M. Design und Leistungsfähigkeit mikroprozessorgesteuerter Kniegelenke. Orthopädie Technik, 2014; 65 (5): 70–79
Hersteller:
[a] Otto Bock Healthcare GmbH, Max-Näder-Str. 15, 37115 Duderstadt, Deutschland
[b] Chas A Blatchford and Sons Ltd, Lister Road, Basingstoke, Hampshire, RG22 4AH, UK
[c] Freedom Innovations, 30 Fairbanks, Ste. 114, Irvine, CA 92618, USA
[d] Rizzoli Ortopedia S. p. A., Via Cesare Battisti 44, 40054 Budrio (BO), Italien
[e] Vicon Motion Systems Ltd, 14 Minns Business Park, West Way, Oxford OX2 OJB, UK
[f] Kistler Instrumente AG, Eulachstr. 22, 8408 Winterthur, Schweiz
[g] Össur Deutschland GmbH, Augustinusstraße 11A, 50226 Frechen, Deutschland
[h] Nabtesco Corporation, 35 Uozakihamamachi, Higashinada-ku, Kobe 658‑0024, Japan
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Ein engagierter Leistungssportler mit Hemiparese und der Einsatz sensomotorischer Fußorthesen (SMFO) — 12. Februar 2026
- Bellmann M, Schmalz T, Ludwigs E, Blumentritt S. Immediate effects of a new microprocessor-controlled prosthetic knee joint: a comparative biomechanical evaluation. Archives of Physical Medicine and Rehabilitation, 2012; 93 (3): 541–549
- Berry D, Olson MD, Larntz K. Perceived Stability, Function, and Satisfaction Among Transfemoral Amputees Using Microprocessor and Nonmicroprocessor Controlled Prosthetic Knees: A Multicenter Survey. Journal of Prosthetics and Orthotics, 2009; 21 (1): 32–42, 10.1097/JPO.0b013e318195b1d1
- Bunce DJ, Breakey JW. The Impact of C‑Leg on the Physical and Psychological Adjustment to Transfemoral Amputation. Journal of Prosthetics and Orthotics, 2007; 19 (1): 7–14
- Swanson E, Stube J, Edman P. Function and Body Image Levels in Individuals with Transfemoral Amputations Using the C‑Leg. Journal of Prosthetics and Orthotics, 2005; 17 (3): 80–84
- Hafner BJ, Willingham LL, Buell NC, Allyn KJ, Smith DG. Evaluation of function, performance, and preference as transfemoral amputees transition from mechanical to microprocessor control of the prosthetic knee. Archives of Physical Medicine and Rehabilitation, 2007; 88 (2): 207–217
- Seymour R, Engbretson B, Kott K, Ordway N, Brooks G, Crannell J, et al. Comparison between the C‑leg microprocessor-controlled prosthetic knee and non-microprocessor control prosthetic knees: a preliminary study of energy expenditure, obstacle course performance, and quality of life survey. Prosthetics and Orthotics International, 2007; 31 (1): 51–61
- Kahle JT, Highsmith MJ, Hubbard SL. Comparison of nonmicroprocessor knee mechanism versus C‑Leg on Prosthesis Evaluation Questionnaire, stumbles, falls, walking tests, stair descent, and knee preference. Journal of Rehabilitation Research and Development, 2008; 45 (1): 114
- Hafner BJ, Smith DG. Differences in function and safety between Medicare Functional Classification Level‑2 and ‑3 transfemoral amputees and influence of prosthetic knee joint control. Journal of Rehabilitation Research and Development, 2009; 46 (3): 417–433
- Berry D, Olson MD, Larntz K. Perceived Stability, Function, and Satisfaction Among Transfemoral Amputees Using Microprocessor and Nonmicroprocessor Controlled Prosthetic Knees: A Multicenter Survey. Journal of Prosthetics and Orthotics, 2009; 21 (1): 32–42, 10.1097/JPO.0b013e318195b1d1
- Seymour R, Engbretson B, Kott K, Ordway N, Brooks G, Crannell J, et al. Comparison between the C‑leg microprocessor-controlled prosthetic knee and non-microprocessor control prosthetic knees: a preliminary study of energy expenditure, obstacle course performance, and quality of life survey. Prosthetics and Orthotics International, 2007; 31 (1): 51–61
- Kahle JT, Highsmith MJ, Hubbard SL. Comparison of nonmicroprocessor knee mechanism versus C‑Leg on Prosthesis Evaluation Questionnaire, stumbles, falls, walking tests, stair descent, and knee preference. Journal of Rehabilitation Research and Development, 2008; 45 (1): 114
- Hafner BJ, Smith DG. Differences in function and safety between Medicare Functional Classification Level‑2 and ‑3 transfemoral amputees and influence of prosthetic knee joint control. Journal of Rehabilitation Research and Development, 2009; 46 (3): 417–433
- Bellmann M. Funktionsprinzipien aktueller Mikroprozessor gesteuerter Prothesenkniegelenke. Orthopädie Technik, 2009; 60: 297–303
- Bellmann M, Schmalz T, Blumentritt S. Comparative biomechanical analysis of current microprocessor-controlled prosthetic knee joints. Archives of Physical Medicine and Rehabilitation, 2010; 91 (4): 644–652
- Kaufman KR, Levine JA, Brey RH, Iverson BK, McCrady SK, Padgett DJ, et al. Gait and balance of transfemoral amputees using passive mechanical and microprocessor-controlled prosthetic knees. Gait Posture, 2007; 26 (4): 489–493
- Blumentritt S, Schmalz T, Jarasch R. The Safety of C‑Leg: Biomechanical Tests. Journal of Prosthetics and Orthotics, 2009; 21 (1): 2–15
- Oehler S, Kraft M, Pusch M. Mobilitäts- und Belastungsmessungen an Oberschenkelamputierten. Ergebnisse einer einjährigen Studie. In: Dössel O (Hrsg.). Biomedizinische Technik/Biomedical Engineering, 2010; 55 (s1): 63–66
- Hochberg Y, Tamhane AC. Multiple comparison procedures. New York, NY: Wiley, 1987
- Dietl H, Kaitan R, Pawlik R, Ferrara P. C‑Leg – Ein neues System zur Versorgung von Oberschenkelamputationen. Orthopädie Technik, 1998; 49: 197–211
- Freedom Innovations. Intelligent Hydraulics: Plié2.0 MPC Knee. http://www.freedom-innovations.com/deutsch/knees/kneevi-deo.html (Zugriff am 05.12.2012)
- James KB. System for controlling artificial knee joint action in above knee prosthesis (EP0549855B1), 1996
- Palmer M, Bisbee CRI. Novel Computer Controlled Prosthetic Knee Device (WO 2007/016408 A1), 2007
- Pusch M. C‑Leg und C‑Leg 2nd Mode: Das elektronische Kniegelenksystem, Wirkungsweise der C‑Leg Steuerung. Seminarunterlagen, 2003
- Turner RA. Hydraulic Dampers with Pressure Regulated Control Valve (US 2009/0140475 A1)
- Nolan L, Wit A, Dudziñski K, Lees A, Lake M, Wychowañski M. Adjustments in gait symmetry with walking speed in trans-femoral and trans-tibial amputees. Gait Posture, 2003; 17 (2): 142
- Schaarschmidt M, Lipfert SW, Meier-Gratz C, Scholle H, Seyfarth A. Functional gait asymmetry of unilateral transfemoral amputees. Human Movement Science, 2012; 31 (4): 907917
- Blumentritt S, Scherer HW, Wellershaws U, Michael JW. Design Principles, Biomechanical Data and Clinical Experience with a Polycentric Knee Offering Controlled Stance Phase Knee Flexion: A Preliminary Report. Journal of Prosthetics and Orthotics, 1997; 9 (1): 18–24
- Schmalz T, Blumentritt S, Jarasch R. Energy expenditure and biomechanical characteristics of lower limb amputee gait: the influence of prosthetic alignment and different prosthetic components. Gait Posture, 2002; 16 (3): 255–263
- Baty D. Der Einfluss des mikroprozessorgesteuerten Prothesenkniegelenks Plie2.0. Orthopädie Technik, 2011; 62: 735–238
- Hanlon M, Anderson R. Prediction methods to account for the effect of gait speed on lower limb angular kinematics. Gait Posture, 2006; 24 (3): 280–287
- Winter DA. Biomechanical motor patterns in normal walking. J Mot Behav, 1983; 15 (4): 302–330
- Kirtley C, Whittle MW, Jefferson RJ. Influence of walking speed on gait parameters. J Biomed Eng, 1985; 7 (4): 282–288
- Lelas JL, Merriman GJ, Riley PO, Kerrigan DC. Predicting peak kinematic and kinetic parameters from gait speed. Gait Posture, 2003; 17 (2): 106–112
- Bellmann M, Schmalz T, Blumentritt S. Comparative biomechanical analysis of current microprocessor-controlled prosthetic knee joints. Archives of Physical Medicine and Rehabilitation, 2010; 91 (4): 644–652
- Wulff W, Kraft M. Entwicklung eines Gangsimulators für Beinprothesen. Orthopädie Technik, 2009; 60 (5): 310–318

![Maximum des Knieflexionswinkels [°] in Abhängigkeit von der Ganggeschwindigkeit [m/s] für alle gemessenen Schritte, Regressionsgerade für alle Ganggeschwindigkeiten und Probanden, links: amputierte Seite.](https://360-ot.de/wp-content/uploads/2020/08/ot_14-05_2_1_Maximumg_Knieflexionswinkel_thiele.png)
![Maximum des Knieflexionswinkels [°] in Abhängigkeit von der Ganggeschwindigkeit [m/s] für alle gemessenen Schritte, Regressionsgerade für alle Ganggeschwindigkeiten und Probanden, rechts: kontralaterale Seite.](https://360-ot.de/wp-content/uploads/2020/08/ot_14-05_2_2_Maximumg_Knieflexionswinkel_thiele.jpg)
![Ganggeschwindigkeit [m/s], gewichtete Mittelwerte und Konfidenzintervalle (alpha = 0.05) über alle Geschwindigkeiten und Probanden.](https://360-ot.de/wp-content/uploads/2020/08/ot_14-05_1_Ganggeschwingdigkeit_thiele.png)
![Maximum des Knieflexionswinkels [°] in Abhängigkeit von der Ganggeschwindigkeit [m/s]: Bestimmtheitsmaß (R2), Norm der Residuen (normr) und Geradengleichung der linearen Regression über alle Probanden und Geschwindigkeiten.](https://360-ot.de/wp-content/uploads/2020/08/ot_14-05_tab_4_Knieflexionswinkel_thiele.jpg)
![Mittlerer Knieflexionswinkel [°] über Gangzyklus [%] am Ende der Schwungphase; Ganggeschwindigkeiten: langsam (links), mittel (Mitte), schnell (rechts).](https://360-ot.de/wp-content/uploads/2020/08/ot_14-05_3_mittlere_Knieflexionswinkel_thiele.jpg)
![Kniewinkelgeschwindigkeit [°/s] kurz vor dem Auftreten, gewichtete Mittelwerte und Konfidenzintervalle (alpha = 0.05) über alle Ganggeschwindigkeiten und Probanden.](https://360-ot.de/wp-content/uploads/2020/08/ot_14-05_4_Kniewinkelgeschwindigkeit_thiele.png)
![Mittlerer Knieflexionswinkel [°] (links) und mittlere Kniewinkelbeschleunigung [°/s2] (rechts) über Gangzyklus [%] während der Standphasenflexion über alle Probanden, Schritte mit bewusster Standphasenflexion.](https://360-ot.de/wp-content/uploads/2020/08/ot_14-05_5_Mittlere_Knieflexionswinkel_thiele.jpg)
![Mittlerer Knieflexionswinkel [°] (links) und mittlere Kniewinkelbeschleunigung [°/s2] (rechts) über Gangzyklus [%] während der Standphasenflexion über alle Probanden, Schritte mit bewusster Standphasenflexion.](https://360-ot.de/wp-content/uploads/2020/08/ot_14-05_6_Minimum_Kniewinkelbeschleuning_thiele.png)
![Minimum des sagittalen Hüftmoments [Nm], gewichteter Mittelwert und Konfidenzintervalle (alpha = 0.05) über alle Probanden für die mittlere Ganggeschwindigkeit.](https://360-ot.de/wp-content/uploads/2020/08/ot_14-05_7_Minimum_Sagittalen_Hueftmoment_thiele.png)