Der Verlust einer Hand bzw. eines Armes oder deren Funktionstüchtigkeit bedeutet für jeden Menschen einen gewaltigen Einschnitt in seiner persönlichen Lebensgeschichte. Die verlorene körperliche Integrität, der Verlust von allgemeinen und spezifischen Handfertigkeiten, aber vor allem der Verlust der persönlichen Unabhängigkeit, sind für die betroffenen Menschen nur schwer zu ertragen. Der Traum, das Verlorene durch biologische und/oder technische Hilfsmittel wiederherzustellen, beschäftigt jeden, der entweder als Arzt oder Betroffener damit konfrontiert wird. Biologisch besteht zumindest für den Handverlust die Möglichkeit der homologen Handtransplantation. Für den Armverlust besteht diese Option auch. Sie ist jedoch aus vielen Gründen zurzeit nicht sinnvoll. Somit bleibt für Armamputierte nur die Möglichkeit der myoelektrischen Prothese. Das große Problem dieser Prothesen ist die sinnvolle Integration in das Körperbild des Patienten. Das gilt sowohl für die motorische Steuerung als auch für die Propriozeption bzw. die spezifische sensible Rückmeldung der Kraftentwicklung am Endorgan – einfach ausgedrückt die „Körperwahrnehmung und Steuerung“.
Dem Ziel, das biotechnologische Interface zu verbessern, gelten die Bemühungen in dem an der Wiener Medizinischen Universität neu gegründeten Christian Doppler Labor für Extremitätenrekonstruktion und Rehabilitation.
Neuromuskuläre Einheiten als Impulsgeber
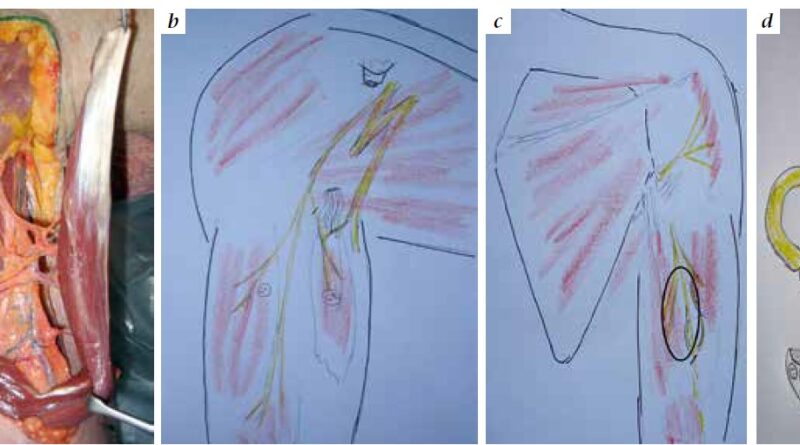
Myoelektrische Prothesen der jetzigen Generation werden meist über zwei transkutane Elektroden verbliebener Muskelstümpfe angesteuert. Bei Patienten mit transhumeralen Stümpfen werden der Musculus bizeps und trizeps, bei glenohumeralen Stümpfen werden meist der Musculus pectoralis major und latissimus dorsi verwendet. Mit diesen beiden Impulsgebern kann der Patient sowohl die Steuerungsebene wechseln als auch in jeder Ebene die jeweilige Funktion mit denselben Muskeln bedienen. Die Schwierigkeit ist natürlich, dass ein und dieselbe „Bewegung“ mit verschiedenen Funktionen der Prothese belegt ist. Das erfordert vom Patienten eine größtmögliche Konzentration, da er die Prothese nicht intuitiv steuern kann. Eine wesentliche Verbesserung ist eine Ansteuerung der einzelnen Bewegungsebenen mit Signalen, die neuronal mit dem natürlichen Bewegungsablauf übereinstimmen. Technisch sind seit Kurzem auch Prothesen mit sieben Steuerungsebenen ausgerüstet. Ziel ist es, die wesentlichen Armnerven wie Nervus musculocutaneus, Nervus radialis, Nervus medianus und Nervus ulnaris aus dem proximalen Armnervengeflecht herauszulösen und an verbliebene Nervenäste von stammnahen Muskeln zu transferieren, um so sinnvolle neuromuskuläre Einheiten zu schaffen, die als Impulsgeber für eine moderne myoelektrische Prothese dienen können (Abb. 1a – d). Als Zielmuskeln bieten sich zunächst die Muskelgruppen im Bereich des Amputationsstumpfes an. Diese Muskeln führen schließlich entsprechend der Aktivität der Spendernerven über transkutane Elektroden die Prothese. Auf diese Weise ist eine harmonische, intuitive, dem natürlichen Bewegungsmuster entsprechende Steuerung gewährleistet, ohne dass der Patient ständig zwischen den verschiedenen Steuerungsebenen wechseln muss.
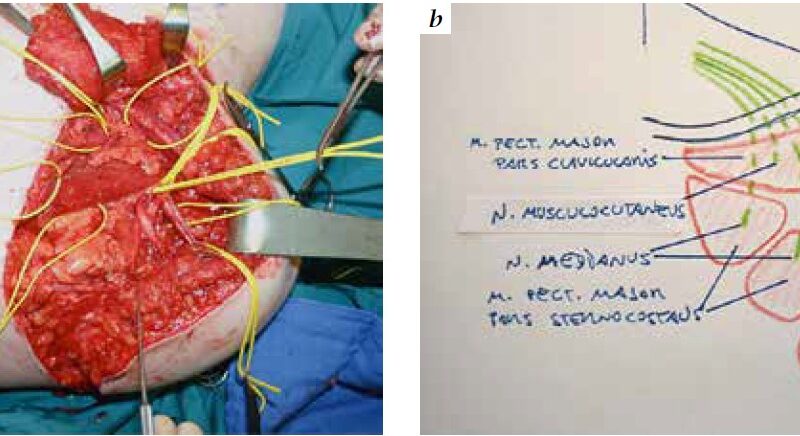
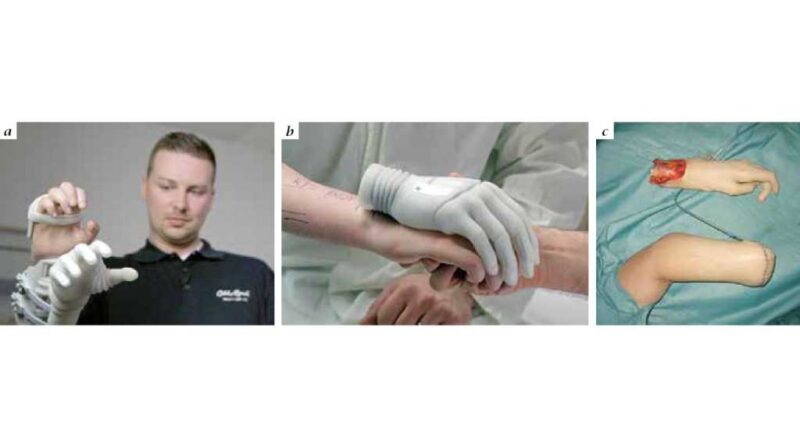
Voraussetzung sind intakte proximale Muskelgruppen und ein weitgehend unbeschädigtes proximales Armnervengeflecht mit der Möglichkeit, Spendernerven entsprechend topographisch-anatomisch isolieren zu können. In der präoperativen Planungsphase und in der postoperativen Verlaufskontrolle wurde gemeinsam mit der Forschungs- und Entwicklungsabteilung der Firma Ottobock ein detailliertes Procedere ausgearbeitet, um möglichst sinnvolle Schaltebenen zu schaffen, die Elektrodenpositionierung zu optimieren und die Prothesenanbindung zu klären (Abb. 2a u. b). Schließlich ist ein komplexes Rehabilitationsprogramm notwendig, um dem Patienten ein optimales Ergebnis zu ermöglichen.
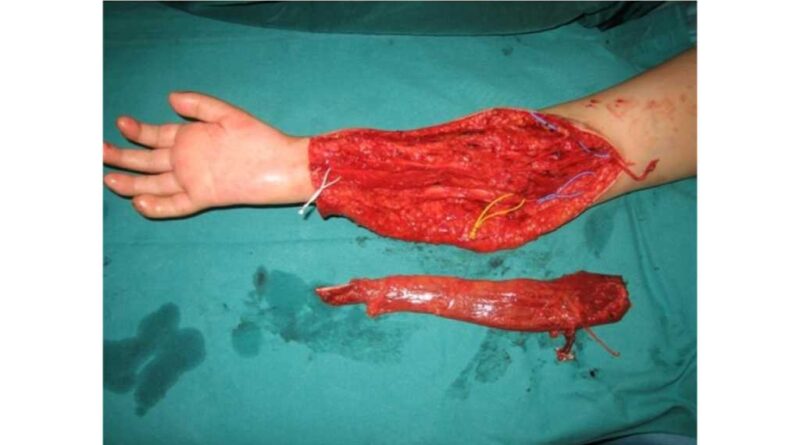
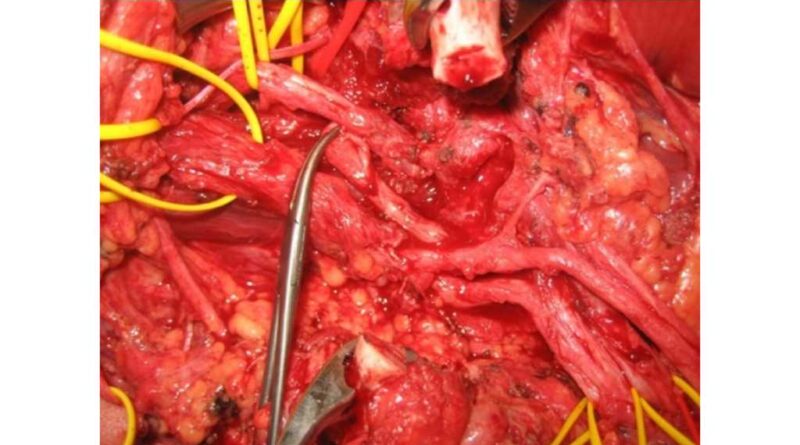
Je nach Amputationshöhe sind verschiedene Nerventransfers möglich, die die neurobiologische Kontaktfläche mit der Prothese erweitern. Selbst auf transhumeraler Ebene sind durch komplexe neuromuskuläre Umordnung vier bis sechs Signalbereiche realisierbar. Das Entscheidende ist eine detaillierte Kenntnis der Anatomie und der spezifischen intraneuralen Topographie, sodass verschiedene Funktionsebenen auch auf limitiertem Raum etabliert werden können und somit eine Steuerung mit größtmöglicher Intuition und Harmonie möglich ist. Selbst in Situationen, in denen ungenügende Zielmuskulatur vorhanden ist, können durch freie funktionelle Muskeltransfers neue Myosignale etabliert werden (Abb. 3a u. b).
Bionische Funktion für funktionslose Extremität
Ein weiteres spannendes Betätigungsfeld der „bionischen Rekonstruktion“ ist die funktionslose obere Extremität. Diese kommt bei Patienten vor, die entweder durch eine Nervenschädigung oder durch einen kritischen Verlust funktioneller Gewebe einen irreversiblen Funktionsverlust der Hand erlitten haben. Auch hier können oben genannte Techniken das biotechnologische Interface so verbessern, dass eine hervorragende bionische Handfunktion erreicht werden kann. Bei manchen Patienten sind selektive Nerventransfers, bei anderen freie funktionelle Muskeltransfers und Veränderungen der skeletalen Strukturen notwendig, um ein bestmögliches Resultat zu erreichen (Abb. 4a – c). Auf diese Weise können selbst Patienten, die schon vor langer Zeit einen solchen Schaden erlitten haben, eine sinnvolle Handfunktion wiedererlangen (Abb. 5a – c).
Rehabilitation
Für ein optimales Endergebnis ist ein mehrstufiges TechNeuroRehabilitationsprogramm notwendig (Tab. 1). Sechs Wochen nach der Operation beginnt eine spezielle Physiotherapie. Zu den Zielen dieser Therapie zählen die Förderung der allgemeinen Fitness und Ausdauer, die Schulung der Bewegungsökonomie sowie ein Rumpf- und Gangtraining.
Je nach Regenerationsfortschritt muss der Patient seine völlig neugeordnete „neurobiologische Landschaft“ erkunden. Diese Erkundungsreise sollte unbedingt mit einem Fährtenleser durchgeführt werden, der dem Patienten hilft, die neuen Signale interpretieren zu können (Patterning). Sobald der Patient bestimmte Signale einer eindeutigen Funktion zuordnen kann, müssen diese gestärkt werden (Strengthening). Dieser Prozess ist eine kognitive Lernfunktion, die vor allem die kortikalen Bewegungszentren (Brodman Area 4 und 6) trainiert. Zudem verbessert er die Signale auf terminaler Ebene und führt so zu ausgereiften Myosignalen.
Der Prozess wird am besten durch verschiedene Feedbackmethoden erleichtert. So werden die Signale zu Beginn mit einem Computerprogramm verknüpft, das dem Patienten eine virtuelle Bewegungskontrolle ermöglicht. Neue „haptische“ Programme können so auch komplexe Bewegungsabläufe trainieren (Virtual Fitting). Sobald der Patient diese Bewegungen ohne Probleme bewältigt, wird die eigentliche Schaftanpassung und Prothesengestaltung vorgenommen (Prosthetic Fitting). Je nach Höhe der Amputation und Komplexität der vorhergehenden Eingriffe, kann dieser Prozess von sechs Wochen bis zu zwei Jahren dauern.
Sensibilität für Prothese und Patient
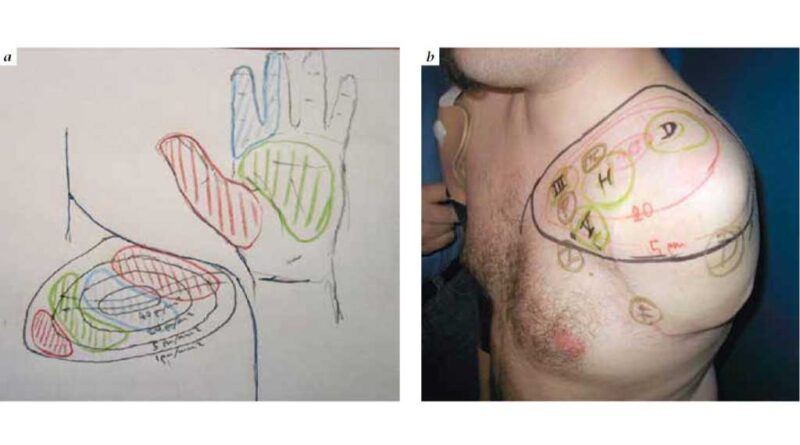
Zuletzt ist es das Anliegen des Wiener Labors, auch eine Art direkte Sensibilität zu erreichen. Zu diesem Zweck werden Hautnerven im Stumpfbereich entweder direkt an den Nervus medianus oder auf höherer Ebene an die Wurzel C6 angelagert. Nach erfolgter Regeneration empfindet der Patient in diesen Hautbereichen eindeutige Areale seiner Hand wie Daumen und Zeigefinger (Abb. 6a – d). Hier sind nicht nur eine vage Oberflächensensibilität, sondern auch spezifische Sinnesqualitäten wie Temperatur und Vibrationsempfindung und eine detaillierte taktile Sensibilität möglich. Damit gibt es eine neurobiologische Grundlage, um die Prothese sinnvoll zu sensibilisieren. Die neu gewonnene Empfindsamkeit am Stumpf kann mit unterschiedlichen Rückmeldesystemen gekoppelt werden. Auch hier wird jedoch ein aufwändiges „TechNeuroRehabilitations“-Programm notwendig sein, damit der Nutzer den Arm wie seinen eigenen wahrnehmen kann.
Im Allgemeinen können junge Patienten diese geistigen „Sprünge“ jedoch mit einiger Übung bewältigen. Letztlich siegt, was einfach ist. Und der Autor ist überzeugt, dass die oben dargestellten Therapieansätze vielen Patienten helfen werden, um eine immer komplexer werdende Technik optimal zu nutzen und damit wieder ein Stück Körperlichkeit zurück zu gewinnen.
Der Autor:
Univ. Prof. Dr. med. Oskar C. Aszmann
Leiter des Labors für Wiederherstellung
von Extremitätenfunktionen
Abteilung für Plastische und
Wiederherstellende Chirurgie
Medizinische Universität Wien
Währinger Gürtel 18–20
A – 1090 Wien
oskar.aszmann@meduniwien.ac.at
Begutachteter Beitrag/Reviewed paper
[1] Aszmann OC, Muse V, Dellon AL. Evidence of collateral sprouting after sensory nerve resection. Ann Plast Surg 1996; 37: 520
[2] Aszmann OC, Rab M, Kamolz LP, Frey M. The anatomy of the pectoral nerves and their significance in brachial plexus reconstruction. J Hand Surg (Am) 2000; 25: 942
[3] Hijjawi JB, Kuiken TA, Lipschutz RD, Miller LA, Stubblefield KA, Dumanian GA. Improved myoelectric prosthesis control accomplished using multiple nerve transfers. Plast Reconstr Surg 2006; 118: 1573
[4] Kuiken TA, Lowery MM, Stoykov NS. The effect of subcutaneous fat on myoelectric signal amplitude and cross talk. Prosthet Orthot Int 2003; 27: 48
[5] Kuiken TA, Dumanian GA, Miller GA, Stubblefield KA. The use of nerve-muscle grafts for improved myoelectric prosthesis control in a bilateral shoulder disarticulation amputee. Prosthet Orthot Int 2004; 28: 245
Aszmann OC. Bionische Rekonstruktion der oberen Extremität. Orthopädie Technik, 2013; 64 (6): S. 34–39
- Konservative Versorgung einer adulten Skoliose mit einem modularen Bausatz – ein Versorgungsbeispiel — 6. März 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 11. Februar 2026