1 Medizinische Hochschule Hannover, Klinik für Unfallchirurgie, Carl-Neuberg-Straße 1, 30625 Hannover, Deutschland
2 Klinik für Unfallchirurgie, Orthopädie und Plastische Chirurgie, Universitätsmedizin Göttingen, Deutschland
3 OTM, John + Bamberg GmbH & Co. KG, Hannover
4 OTM, Brandes & Diesing OHG, Hannover
Allgemeines und Prävalenzen
In Deutschland werden jährlich ca. 56.000 Amputationen durchgeführt. Die Amputationszahlen steigen gegenwärtig jährlich um 6,7 %. Gleichzeitig sinken dabei die Zahlen an Majoramputationen1.
11,5 % dieser Amputationen sind transtibiale Amputationen2. Aus biomechanischer Perspektive ist eine transtibiale Amputation mit Erhalt der Kniegelenkfunktion einer Oberschenkelamputation und Knieexartikulation überlegen. Kurze transtibiale Stümpfe können bis zu einer Länge von 5–6 cm und Erhalt des Ansatzes der Patellarsehne funktionell sein3.
Chirurgische Grundprinzipien der transtibialen Amputation und ihre Modifikationen
Chirurgische Zielgrößen für eine erfolgreiche prothetische Versorgung sind ein funktioneller, sensibler und suffizient weichteilgedeckter Stumpf4.
Stumpflänge
Bei der Planung der Osteotomiehöhe bleibt eine Tibialänge von 5 cm funktionell prothetisch versorgbar. Ab einer Tibialänge von 8 cm wird empfohlen, die Fibula zu entfernen, da auf dieser Höhe die Membrana interossea fehlt und es so zu Druckstellen aufgrund der häufigeren Dislokation der Fibula kommen kann5. Brückner beschrieb für vaskulär kompromittierte Patienten, dass eine Tibialänge von 9 cm mit weniger Komplikationen einhergeht6. Tibialängen von bis zu 16–18 cm haben in der Regel eine gute Weichteildeckung durch die kräftigen Muskelbäuche auf dieser Amputationshöhe. Bei Stumpflängen darüber hinaus kann eine suffiziente Weichteildeckung aufgrund des sehnigen, distalen Anteils der Unterschenkelmuskeln erschwert sein. Die Fibula sollte 1–2 cm kürzer als die Tibia sein und die Tibia sollte im ventralen Drittel abgerundet werden7.
Weichteilmanagement
Die Planung des Hautlappens wird durch die verfügbare intakte Haut und Weichteile determiniert. Es hat sich nach Burgess ein langer dorsaler Lappen (Haut der Wade bis zur Achillessehne) und ein kurzer ventraler Hautlappen durchgesetzt, die in einer ventralen, horizontalen Narbe abheilen8 9. Diese Technik wurde später von Brückner modifiziert10. Eine Alternative sind zwei symmetrische mediale und laterale Hautlappen mit einer vertikalen Narbe (sagittaler Zugang) 11 12 13.
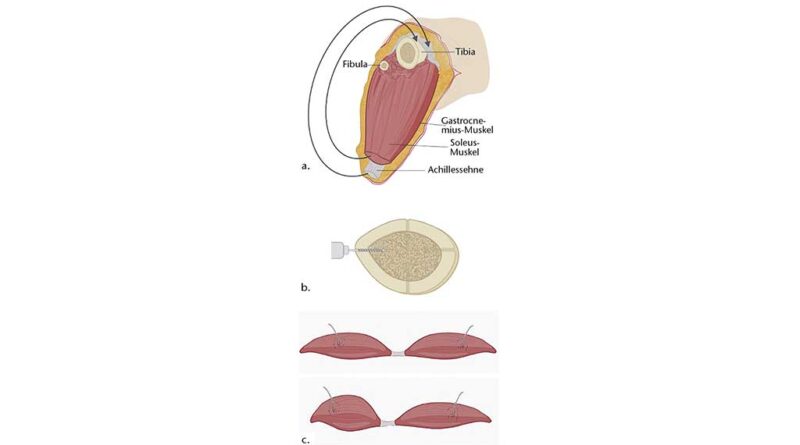
Die tiefen und oberflächlichen Flexoren inklusive des M. soleus, die Unterschenkelextensoren und die lateralen Muskeln der Peronealloge werden so weit proximal wie möglich reseziert und entfernt. Der mediale und/oder laterale Gastrocnemiusbauch wird von dorsal nach ventral um die Tibia und Fibula geschlagen. Die oberflächlichen Faszien der Mm. gastrocnemii werden an die der Stümpfe der Mm. peronaei bzw. an das mediale Periost der Tibia mit resorbierbarem Nahtmaterial fixiert (Myoplastik, Myopexie). Eine Modifikation der Fixierung von Muskelstümpfen ist die transossäre Fixation des Muskellappens durch Bohrlöcher durch die Tibia (Myodese nach Bowker) 14 15 16, s. Abb. 1a, b.
Durch die Refixierung der Muskulatur um den Knochen verbessert sich ebenso die Durchblutung des Stumpfendes. Eine zu enge, strangulierende Muskelnaht hingegen kann zu Muskelnekrosen führen. Mechanisch widerstandsfähiger sind die Muskelfaszien, die in den drei oben genannten Techniken von dem Nahtmaterial satt und muskelsparend gegriffen werden sollten, um eine stabile Naht zu ermöglichen17 18 19.
Die Transposition und Refixation der Stumpfmuskulatur ist wichtig, um eine komfortable, sichere und robuste Schaftanpassung erzielen zu können. Aus orthopädietechnischer Perspektive sollte dies so erfolgen, dass insgesamt eine konische Form des Unterschenkelstumpfes erzielt wird. Demnach lässt sich ein Stumpf mit dreieckigem, konischem Querschnitt drehstabil in den Prothesenschaft einbetten. Eine Birnenform erschwert die Prothesenversorgung und eine schnelle Atrophie der Unterschenkelmuskeln ermöglicht die definitive Prothesenversorgung und damit die Mobilisation und Rehabilitation20 21. In der klinischen Versorgung sind wir jedoch häufiger mit den Komplikationen distal und am Fibulaköpfchen insuffizient weichteilgedeckter Unterschenkelstümpfe konfrontiert als Folge der Atrophie der konischen Stumpfformung.
Grenzen der gegenwärtigen Prinzipien der Unterschenkelamputation
Das stabile Vernähen von Muskulatur miteinander grenzt am Stumpf wie auch in anderen Bereichen der Chirurgie an biomechanische Grenzen22. Unabhängig vom Nahtmaterial können Nähte aus der weichen, bei Muskelkontraktur stets bewegenden Muskulatur ausreißen, insbesondere wenn das Knie vor abgeschlossener Vernarbung bewegt wird. Dies kann auch bei einer transossären Fixation der Muskelstümpfe auftreten23.
Die Dislokation der Muskelstümpfe nach proximal führt zu einer insuffizienten Weichteildeckung der Tibia- und Fibulaenden, bis das Stumpfende nur noch mit Vollhaut bedeckt ist. Dies kann zu Druckstellen, Ulzerationen und Stumpfschmerzen führen. Um die Muskelnaht stabil in einer Vernarbung abheilen zu lassen, hat Brückner eine Immobilisation der Kniebeugung bis zur stabilen Ausheilung empfohlen24.
Der Anteil oben beschriebenen Abgleitens der Muskeln vom Stumpfende mit notwendiger chirurgischer Revision tritt in ca. 6 % der Fälle auf, insbesondere, wenn der Stumpf in eine Prothese mit zu engem Schafteingang angepasst wird. Durch den Zug an den Muskeln beim Einsteigen in den Schaft kann das Ausreißen begünstigt werden25 26 27.
Ein weiteres wichtiges Ziel der chirurgischen Refixierung der Muskeln um den Knochenstumpf ist neben der Weichteildeckung der Erhalt der physiologischen Vorspannung der Muskeln28. Durch die Amputation verlieren die Muskeln ihren distalen Ansatz. Durch die fehlende distale Insertion ziehen sie sich zurück und können sich trotz intakter Innervation nicht mehr kontrahieren29.
Um die Polsterung des knöchernen Stumpfes und den distalen Reinsertionspunkt der Muskeln zu erreichen, werden die Muskelstümpfe bisher wie oben beschrieben über dem knöchernen Stumpfende miteinander vereinigt (wahlweise die Agonisten und Antagonisten, Myoplastik) oder transossär am Knochen fixiert (Myopexie, Myodese) 30. In seinen Reiseberichten nach der Rückkehr von seinem Kollegen Marian Weiss aus Wierzejewskiego beschrieb der Amputationschirurg Ernest Martin Burgess die gute Stumpfpolsterung und erhaltene Propriozeption, nachdem er diese Stumpfmuskel-adressierende Vorgehensweise erstmals gesehen hatte31. Diese klinische Beobachtung konnte 1967 und bis heute weder für die Myoplastik noch für die Myodese objektiviert werden32.
Agonisten-Antagonisten-Myoneural-Interface (AMI)
Die Propriozeption beschreibt unseren Lagesinn. Also die Fähigkeit, bei geschlossenen Augen genau zu wissen, in welcher Position sich Körperteile befinden33. Propriozeption wird zentral im Großhirn durch neurale Informationen aus dem Kleinhirn, den Gehörgängen, aus spinaler Ebene und Informationen aus peripheren Sinnesorganen in Muskeln, Sehnen, Gelenkkapseln und Haut verrechnet34 35. Bei diesen peripheren Sinnesorganen wird die Propriozeption in erster Linie durch Mechanorezeptoren vermittelt, die als Muskelspindeln und Golgi-Sehnenorgane bezeichnet werden und Muskellänge, ‑geschwindigkeit und ‑spannung wahrnehmen. Diese Rezeptoren sind in den Muskeln und am Muskel-Sehnen-Übergang lokalisiert36.
In den Extremitäten überspannen Muskelpaare ein Gelenk und sind als Agonist und Antagonist miteinander gekoppelt. Eine afferente Signalübertragung der Information von den Mechanorezeptoren bei Bewegungen der Gliedmaßen wird durch die Muskelanspannung und ‑entspannung der Agonisten und Antagonisten codiert. Bei der Fußhebung führt eine Kontraktion der Fußheber (Extensoren und M. tibialis anterior) zu einer Dehnung der entspannten Fußsenker (Flexoren, Mm. gastrocnemius medialis und lateralis sowie M. soleus).
Das bisherige Vorgehen bei einer transtibialen Amputation berücksichtigt nicht oder nur unvollständig die anatomische und neuromechanische Kopplung von Agonisten und Antagonisten (Abb. 1a, b).
Schnelle Reaktionen zur Korrektur der Haltung und zum Ausgleich des Gleichgewichts beim Gehen sind für Beinamputierte durch die gestörte motorische Kontrolle und propriozeptive Wahrnehmung stark beeinträchtigt37 38 39 40.
In Untersuchungen der Arbeitsgruppe der Erstbeschreiber der AMI-Technik und ihren Nachuntersuchungen konnten nach Wiederherstellung der Kopplung von Agonisten und Antagonisten im Rahmen der Amputation eine verbesserte motorische Kontrolle und propriozeptive Wahrnehmung gezeigt werden41 42 43 44 45.
Diese Ergebnisse als auch die Prävalenz der Vorstellung von insuffizient weichteilgedeckten transtibialen Stümpfen mit exponierter Tibiakante und Fibulaköpfchen in unserer Amputationssprechstunde motivierten uns zur Einführung dieser Operationsmethode im Januar 2022. Im Folgenden berichten wir über die ersten perioperativen Ergebnisse dieser innovativen Interpretation der Muskeltransposition für transtibial Amputierte.
Methoden
Patientenkollektiv
Transtibial Amputierte, die im Zeitraum von Januar 2022 bis Dezember 2023 AMIs erhielten, wurden eingeschlossen. Kontraindikationen waren ein massives Muskeltrauma, mangelnde Compliance und ein reduzierter Allgemeinzustand, der eine Operationszeit von mehr als drei Stunden verbietet.
Operative Schritte des transtibialen Agonisten-Antagonisten-Myoneural-Interface
Die Osteotomie wird bei einer Länge von 14–16 cm und die Hautlappen mit einem langen dorsalen Lappen geplant. Während der transtibialen Amputation werden bei der AMI-Methode der M. tibialis anterior und ein Bauch des M. gastrocnemius unter Vorspannung an den intramuskulären Anteil der Sehnen ventral der Tibia miteinander durch eine Sehnennaht verknüpft, um die muskuläre Kopplung der Fußhebung und ‑senkung (oberes Sprunggelenk) zu rekonstruieren. Diese Verbindung wird von einer gleitenden Struktur umschlossen. Dazu kann eine glatte faszienartige Struktur, der Tarsaltunnel oder das Retinakulum (extensorum) verwendet werden. Sollte dies aufgrund von Infektionen oder Nekrosen nicht möglich sein, kann alternativ eine azelluläre dermale Matrix verwendet werden. Das Gleitlager wird an der lateralen Tibiakante im distalen Drittel des Knochens mit transossären Ankernähten fixiert und das Gleitlager sodann verschlossen.
Zur Rekonstruktion der Inversion und Eversion des unteren Sprunggelenks wird in gleicher Vorgehensweise wenige Zentimeter distal vom ersten AMI der M. peroneus longus mit dem M. tibialis posterior verbunden (Abb. 1c). Der verbleibende M. soleus wird bei sicherer Durchblutung von dorsal nach ventral über AMI I und II geschlagen und der Muskel mit seiner Faszie an der ventralen oberflächlichen Körperfaszie fixiert, bevor der lange dorsale Hautlappen umgeschlagen und die Haut verschlossen wird46, Abb. 1c. Die durchtrennten Nerven werden anschließend zur Prävention von schmerzhaften Stumpfneuromen mithilfe eines selektiven Nerventransfers auf sensible Hautnerven (Targeted Sensory Reinnervaion, TSR), motorische Empfängernerven von Nicht-AMI-Muskeln (Targeted Muscle Reinnervation, TMR) oder in ein kleines avaskuläres Muskeltransplantat (Regenerative Peripheral Nerve Interface, RPNI) koaptiert. Diese Methoden reduzieren nachweislich die Prävalenz von Neurom- und Phantomschmerzen47 48 49 50 51 52.
Alle weiteren, nicht-prozessierten Muskeln im transtibialen Amputationsstumpf werden weit proximal abgesetzt und reseziert. Vor dem Umschlagen des langen dorsalen Hautlappens sollte eine Drainage eingelegt werden. Es folgt der zweischichtige Wundverschluss. Sollten keine Kontraindikationen vorliegen, wird zur antiödematösen Therapie ein weißer Schwamm auf der Hautnaht aufgelegt und mit einem epikutanen Vakuumsystem versorgt. Im Operationssaal wird der Stumpf bis Mitte des Oberschenkels über das anliegende Vakuumsystem mit Watte und elastischer Wicklung moderat gewickelt und in einer Schiene in Kniestreckung unter Aufhebung der Knieflexion (Knie-Immobilisations-Schiene) für vier bis sechs Wochen Tag und Nacht ruhiggestellt.
Nachbehandlung
Das epikutane Vakuumsystem wird auf Station nach fünf bis sieben Tagen abgenommen. Dann wird der Stumpf mit einem Pflaster und einem rundgestrickten Stumpfkompressionsstrumpf der Kompressionsklasse II über dem Pflaster versorgt. Postoperativ wird der Stumpf inklusive des Knies in zwei Ebenen geröntgt. Die Fäden oder Hautklammern werden erst nach sicherer Wundheilung 21 bis 28 Tage nach Amputation entfernt. Die Knieflexion und Belastung werden nach sechs Wochen vollständig freigegeben. Ab diesem Zeitpunkt sollen Fußhebung und ‑senkung sowie In- und Eversion dreimal täglich 20-mal durch eine aktive Kontraktion der AMI-Muskeln beübt werden. Zum Training wird dem Patienten ein visualisiertes Bewegungsprotokoll mit den oben beschriebenen Bewegungen ausgehändigt.
Outcome-Parameter
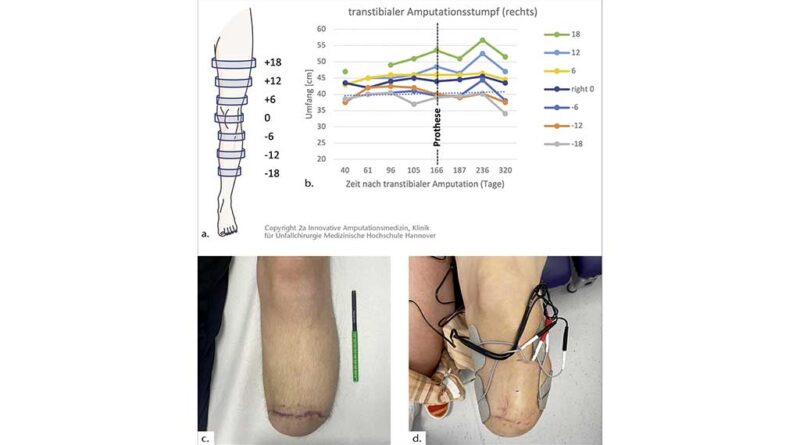
Anzahl, Geschlecht, Alter und Ursache der transtibialen Amputation, Anzahl der AMIs, Komplikationen und klinische Schmerzerhebung wurden dokumentiert und analysiert. Umfänge des Amputationsstumpfes in Sechs-Zentimeter-(cm)-Schritten bis 18 cm proximal der Kniebeugefalte wurden in den klinischen Verlaufskontrollen erhoben und longitudinal im Beobachtungszeitraum illustriert.
Ergebnisse
Im 24-monatigen Beobachtungszeitraum wurden 20 transtibiale Amputationen mit einem AMI versorgt. Bei allen transtibialen Amputationen wurden zwei AMIs rekonstruiert (AMI I, AMI II), s. Abb. 1c, Tab. 1.
Die Ursachen für eine transtibiale Amputation waren dabei akutes Trauma (n = 7), Diabetes mellitus und/oder Durchblutungsstörungen (n = 1), Sepsis (n = 4), Spätversagen von Extremitätenrekonstruktionen (n = 5), Infektion ohne Sepsis (n = 1), Tumor (n = 1) und eine Amputation im Rahmen einer angeborenen Fehlbildung (s. Tab. 1). 14 Patienten waren unilateral betroffen, drei weitere bilateral. Im Beobachtungszeitraum traten drei Komplikationen auf: zwei Frühinfektionen (n = 2) und ein Spätinfekt (n = 1), die zur Resektion von mindestens einem AMI (n = 2) führten, und eine (n = 1) Nachamputation mit Konversion zu einer Knieexartikulation unter Erhalt und Transposition der AMIs I und II (s. Tab. 1).
Umfänge
Die im Rahmen der klinischen Untersuchung erhobenen Umfänge (in cm, hier exemplarisch für n = 1, transtibial rechts) zeigen bis zur Mobilisation einen zunehmenden Trend an allen Messpunkten in jeweils 6 cm Abständen nach proximal und distal ab Kniebeugefalte. Nach Ausgabe der Interimsprothese an Tag 166 nach Amputation (Anmerkung: Dies war eine sepsisassoziierte Amputation mit einer retrahierten Mobilisation aufgrund des initialen sepsisgeschwächten Allgemeinzustandes) reduziert sich der Umfang an drei von sieben Messpunkten. Gefolgt wird dies von einem Umfangs-Peak an sechs von sieben Messpunkten, der 70 Tage nach Mobilisation auf der Interimsprothese auf Umfangswert nahe direkt nach Amputation sistiert (Abb. 2a, b).
Diskussion
Die Konstruktion von AMIs konnte bei einer Vielzahl der Indikationen – von Trauma bis Diabetes-mellitus-assoziierten Amputationen – im Rahmen der primären Amputation im Beobachtungszeitraum durchgeführt werden. In 16 % (n = 3) der Fälle kam es zu einer Komplikation, die eine chirurgische Revision erforderte. In 5 % der Fälle (n = 1) war eine Nachamputation unter Verlust des Knies notwendig. Diese Komplikationen traten im Rahmen einer traumatischen Amputation aufgrund einer komplexen Extremitätenverletzung mit hohem Grad an Kontamination im Rahmen einer (sub-)totalen Amputation (n = 2) oder einer Amputation nach Spätversagen einer Extremitätenrekonstruktion mit chronischem Infekt auf. Beide Indikationen implizieren allein bereits ein hohes Risikoprofil für postoperative Revisionen. Überraschenderweise erlitt keine Amputation im Rahmen von Diabetes mellitus und seinen Folgen mit einer AMI-Versorgung eine Komplikation.
Es konnte in der klinischen Untersuchung im Beobachtungszeitraum keine Dislokation der AMIs objektiviert werden. Die AMI-Muskeln konnten reliabel von allen Patienten entsprechend ihrer Funktion angesteuert werden und führten zu einer palpablen und sichtbaren Kontraktion des entsprechenden Muskels am Amputationsstumpf, ohne dass der transponierte Muskel zu einer unkontrollierbaren Weichteilmasse („padding“) führte53.
Die im Rahmen der klinischen Untersuchung erhobenen Umfänge zeigen eine Zunahme mit einer Hypertrophie nach täglicher Mobilisation in der Interimsprothese, die dann leicht abnimmt und sich auf einem stabilen Niveau einpendelt. Insgesamt reduziert sich der Umfang in keinem Messpunkt im Beobachtungszeitraum von bis zu einem Jahr um mehr als 10 %. Dies ist deutlich weniger als Vergleichsmessungen von Stumpfvolumina und ‑umfängen nach Standardamputationen. In einem Review von Sanders und Fatone wird eine Volumenreduktionen von 17–35 % und eine Volumenstabilisierung 100 Tage nach Standardamputation dokumentiert54.
Dies wird in Abbildung 2 exemplarisch an einem rechten transtibialen Amputationsstumpf dargestellt. Trotz erwartet abnehmender postoperativer Schwellung bis zur Mobilisation in der Prothese wurde keine Umfangsreduktion, sondern eine Zunahme gemessen. Dies kann auf die im ausgehändigten Bewegungsprotokoll instruierte gezielte Anspannung der AMI-Muskeln ab der sechsten postoperativen Woche zurückgeführt werden. Nach regelmäßigem Gehen in der Prothese, hier gekennzeichnet als Ausgabe der Interimsprothese an Tag 166 nach Amputation (Anmerkung: Dies war eine sepsisassoziierte Amputation mit einer retrahierten Mobilisation aufgrund des initial sepsisreduzierten Allgemeinzustandes), verringert sich der Umfang in den überwiegenden Messpunkten. Dies kann auf die effektive Kompression des Schaftes unter täglicher Mobilisation in Zusammenhang mit einem residuellem Ödem zurückzuführen sein. Gefolgt wird dies von einem Umfangs-Peak an sechs von sieben Messpunkten. 100 Tage nach Mobilisation stabilisieren sich die Umfänge auf einem Wert direkt nach Amputation. Der Peak nach Mobilisation könnte eine reaktive Hypertrophie der Muskulatur als Antwort auf die Mehrbelastung in der Prothese sein.
Die longitudinale Analyse der gemittelten Umfänge zeigte einen Trend zur Umfangszunahme als unmittelbar messbaren Effekt in der Nachbeobachtung dieser neuen Amputationsmethode mit relevanten Auswirkungen für einen robusteren Stumpf (Abb. 2 a–d). Es bleibt abzuwarten, wie nachhaltig in Stabilität und Funktionalität die gleitenden AMI-Konstrukte an der ventralen Tibia sind.
Neben einer im ausgehändigten Bewegungsprotokoll deutlich geringen Prävalenz von Phantom- und Neuromschmerzen (n = 1/13) in dieser analysierten Subgruppe im Vergleich zu Prävalenzen nach Standard-Amputation gaben alle Patienten ein ungestörtes Phantomgefühl der amputierten Extremität an. Eine detaillierte Analyse der Schmerzen war hier nicht Gegenstand des vorliegenden Artikels. In Zukunft könnte es interessant sein zu untersuchen, welchen Einfluss diese neue Operationsmethode auf das Embodiment hat. Weiterhin sollte systematisch untersucht werden, wie hoch die propriozeptive Fähigkeit ist, und ob dies möglicherweise klinisch relevante Auswirkungen auf Balance und Gehvermögen hat. Die insgesamt niedrige Prävalenz amputationsassoziierter Schmerzen könnte auch Folge des selektiven Nerventransfers (TMR, TSR, RPNI) sein.
Die Kopplung der Agonisten und Antagonisten wurde bereits im letzten Jahrhundert zur direkten Kraftübertragung und verbesserten Armprothesensteuerung unter dem Begriff „Kineplastik“ beschrieben55 56.
Wir haben wie unser Kollege in Boston (M. Carty, Brigham and Women’s Hospital, Harvard Medical School Boston) in Analogie zur transtibialen Amputation das AMI-Verfahren für transradiale Amputationen durchgeführt. Anders als bei der Kineplastik wird hier die Kopplung der Agonisten und Antagonisten nun nicht zur direkten Kraftübertragung wie bei der originären Kineplastik, wohl aber zur indirekten Kraftübertragung genutzt. Es konnten nach Ausheilung der Sehnennaht unmittelbar sechs bis zu acht Myosignale zur myoelektrischen Steuerung der Handprothese genutzt werden.
Die transponierten und gekoppelten Muskeln der transtibialen AMIs sind unter Laborbedingungen bereits zur myoelektrischen Steuerung von mechatronischen Sprunggelenken eingesetzt worden. Die gezielte Transposition erlaubt eine reliable Ansteuerung unter Verwendung von Oberflächenelektroden57. Weitere sekundäre und tertiäre Einflüsse dieses sogenannten Closed-loop-Mechanismus von rekonstruierter Propriozeption (Sensorik) und Myosignalen (motorischer Kontrolle) könnten neue Versorgungsdimensionen für Unterschenkelamputierte bedeuten.
Für die Autoren:
Victor Hoursch
Assistenzarzt in Weiterbildung
Klinik für Unfallchirurgie
Medizinische Hochschule Hannover
Carl-Neuberg-Straße 1
30625 Hannover
Hoursch.Victor@mh-hannover.de
Begutachteter Beitrag/reviewed paper
Hoursch V et al. Agonisten-Antagonisten-Myoneural-Interface (AMI) – eine neue Versorgungsdimension für den transtibialen Stumpf? Orthopädie Technik, 2024; 75 (5): 82–88
Tab. 1 Demographie und Amputationsursache der transtibialen Agonisten-Antagonisten-Myoneural-Interfaces (AMI) im Beobachtungszeitraum.
| Gesamt | Trauma | Diabetes mellitus und/oder Durchblutungsstörungen | Sepsis | Infektion ohne Sepsis | Spätversagen von Extremitätenrekonstruktionen | Kongenital | Tumor | |
|---|---|---|---|---|---|---|---|---|
| Anzahl der Patienten | 20 | 7 | 1 | 4 | 1 | 5 | 1 | 1 |
| Geschlecht M/F | 16/4 | 7/0 | 1/0 | 3/1 | 1/0 | 4/1 | 0/1 | 0/1 |
| Alter bei AMI-Amputation (ø, Jahre) | 52, 35 | 50, 42 | 85 | 57, 25 | 53 | 54, 17 | 2 | 53 |
| Komplikationen | 3 | 2 | – | – | – | 1 | – | – |
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- Ein engagierter Leistungssportler mit Hemiparese und der Einsatz sensomotorischer Fußorthesen (SMFO) — 12. Februar 2026
- Spoden M, Nimptsch U, Mansky T. Amputation rates of the lower limb by amputation level – observational study using German national hospital discharge data from 2005 to 2015. BMC Health Services Research, 2019; 19 (1): 8
- Spoden M, Nimptsch U, Mansky T. Amputation rates of the lower limb by amputation level – observational study using German national hospital discharge data from 2005 to 2015. BMC Health Services Research, 2019; 19 (1): 8
- Baumgartner R. Unterschenkelamputation. Operative Orthopädie und Traumatologie, 2011; 23 (4): 280–288
- Souza JM, Wade SM, Harrington CJ, Potter BK. Functional Limb Restoration Through Amputation: Minimizing Pain and Optimizing Function With the Use of Advanced Amputation Techniques. Annals of Surgery, 2021; 273 (3): e108–e113
- Souza JM, Wade SM, Harrington CJ, Potter BK. Functional Limb Restoration Through Amputation: Minimizing Pain and Optimizing Function With the Use of Advanced Amputation Techniques. Annals of Surgery, 2021; 273 (3): e108–e113
- Stahel PF, Oberholzer A, Morgan SJ, Heyde CE. Concepts of transtibial amputation: Burgess technique versus modified Brückner procedure. ANZ Journal of Surgery, 2006; 76 (10): 942–946
- Souza JM, Wade SM, Harrington CJ, Potter BK. Functional Limb Restoration Through Amputation: Minimizing Pain and Optimizing Function With the Use of Advanced Amputation Techniques. Annals of Surgery, 2021; 273 (3): e108–e113
- Souza JM, Wade SM, Harrington CJ, Potter BK. Functional Limb Restoration Through Amputation: Minimizing Pain and Optimizing Function With the Use of Advanced Amputation Techniques. Annals of Surgery, 2021; 273 (3): e108–e113
- Burgess EM, Zettl JH. Amputations below the knee. Artificial Limbs, 1969; 13 (1): 1–12
- Stahel PF, Oberholzer A, Morgan SJ, Heyde CE. Concepts of transtibial amputation: Burgess technique versus modified Brückner procedure. ANZ Journal of Surgery, 2006; 76 (10): 942–946
- Persson BM. Sagittal incision for below-knee amputation in ischaemic gangrene. Journal of Bone & Joint Surgery, 1974; 56 (1): 110–114
- Alter AH, Moshein J, Elconin KB, Cohen MJ. Below knee amputation using the sagittal technique: a comparison with the coronal amputation. Clinical Orthopaedics, 1978; 131: 195–201
- Tisi PV, Than MM. Type of incision for below knee amputation. Cochrane Database of Systematic Reviews, 2014; 4: CD003749
- Baumgartner R. Unterschenkelamputation. Operative Orthopädie und Traumatologie, 2011; 23 (4): 280–288
- Bowker J. Minor and Major Lower-Limb Amputations and Disarticulations in Patients with Diabetes Mellitus. Levin and O‘Neal‘s The Diabetic Foot, 2008; 403–428
- Morris CD, Potter BK, Athanasian EA, Lewis VO. Extremity amputations: principles, techniques, and recent advances. Instructional course lectures, 2015; 64: 105–117
- Baumgartner R. Unterschenkelamputation. Operative Orthopädie und Traumatologie, 2011; 23 (4): 280–288
- Schrock Jr RD, Zettl JH, Burgess EM, Romano RL. A preliminary report of basic studies from Prosthetics Research Study. Bulletin of prosthetics research, 1968; 10: 90–105
- Pino AE, Taghva S, Chapman C, Bowker JH. Lower-limb amputations in patients with diabetes mellitus, Orthopedics, 2011; 34 (12): e885–e892
- Baumgartner R. Unterschenkelamputation. Operative Orthopädie und Traumatologie, 2011; 23 (4): 280–288
- Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung, Indikationsstellung – operative Technik – Nachbehandlung – Funktionstraining. Stuttgart: Thieme, 2016
- Kragh JF et al. Suturing of lacerations of skeletal muscle. Journal of Bone & Joint Surgery, 2005; 87 (9): 1303–1305
- Ponce BA et al. A biomechanical analysis of controllable intraoperative variables affecting the strength of rotator cuff repairs at the suture-tendon interface. American Journal of Sports Medicine, 2013; 41 (10): 2256–2261
- Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung, Indikationsstellung – operative Technik – Nachbehandlung – Funktionstraining. Stuttgart: Thieme, 2016
- Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung, Indikationsstellung – operative Technik – Nachbehandlung – Funktionstraining. Stuttgart: Thieme, 2016
- Pascale B, Potter B. Residual Limb Complications and Management Strategies. Current Physical Medicine and Rehabilitation Reports, 2014; 2: 241–249
- Tintle SM et al. Reoperation after combat-related major lower extremity amputations. Journal of Orthopaedic Trauma, 2014; 28 (4): 232–237
- Gottschalk F. Transfemoral amputation. Biomechanics and surgery. Clinical Orthopaedics and Related Research, 1999; 361: 15–22
- Greitemann B, Brückner L, Schäfer M, Baumgartner R. Amputation und Prothesenversorgung, Indikationsstellung – operative Technik – Nachbehandlung – Funktionstraining. Stuttgart: Thieme, 2016
- Geertzen JHB et al. Myodesis or myoplasty in transfemoral amputations. What is the best option? An explorative study. Medical Hypotheses, 2019; 124: 7–12
- Warren R. Early Rehabilitation of the Elderly Lower Extremity Amputee. Surgical Clinics of North America, 1968; 48 (4): 807–816
- Geertzen JHB et al. Myodesis or myoplasty in transfemoral amputations. What is the best option? An explorative study. Medical Hypotheses, 2019; 124: 7–12
- Tuthill JC, Azim E. Proprioception. Current Biology, 2018; 28 (5): R194–R203
- Proske U, Gandevia SC. The proprioceptive senses: their roles in signaling body shape, body position and movement, and muscle force. Physiological Reviews, 2012; 92 (4): 1651–1697
- Edin BB, Johansson N. Skin strain patterns provide kinaesthetic information to the human central nervous system. Journal of Physiology, 1995; 487 (1): 243–251
- Day J et al. Muscle spindles in human tibialis anterior encode muscle fascicle length changes. Journal of Neurophysiology, 2017; 117 (4): 1489–1498
- Vanicek N, Strike S, McNaughton L, Polman R. Postural responses to dynamic perturbations in amputee fallers versus nonfallers: a comparative study with able-bodied subjects. Archives of Physical Medicine and Rehabilitation, 2009; 90 (6): 1018–1025
- Beurskens R, Wilken JM, Dingwell JB. Dynamic Stability of Individuals with Transtibial Amputation Walking in Destabilizing Environments. Journal of Biomechanics, 2014; 47 (7): 1675–1681
- Metzger AJ et al. Feedforward control strategies of subjects with transradial amputation in planar reaching. Journal of Rehabilitation Research and Development, 2010; 47 (3): 201–211
- Shell CE et al. Lower-Limb Amputees Adjust Quiet Stance in Response to Manipulations of Plantar Sensation. Frontiers in Neuroscience, 2021; 15: 611926
- Shell CE et al. Lower-Limb Amputees Adjust Quiet Stance in Response to Manipulations of Plantar Sensation. Frontiers in Neuroscience, 2021; 15: 611926
- Petrini FM et al. Enhancing functional abilities and cognitive integration of the lower limb prosthesis. Science Translational Medicine, 2019; 512 (11): eaav8939
- Clites TR et al. The Ewing Amputation: The First Human Implementation of the Agonist-Antagonist Myoneural Interface. Plastic and Reconstructive Surgery–Global Open, 2018; 6 (11): e1997
- Sullivan C et al. Clinical, Functional, and Sensorial Outcomes of the Agonist-Antagonist Myoneural Interface (AMI) Ewing Amputation. Plastic and Reconstructive Surgery–Global Open, 2023; 11 (10S): 124
- Chiao RB et al. Patient Reported Outcome Measures (PROMs) Amongst Lower Extremity Agonist-Antagonist Myoneural Interface (AMI) Amputees. Applied Sciences, 2023; 13 (18): 10508
- Berger L et al. The Ewing Amputation: Operative technique and perioperative care. Orthoplastic Surgery, 2023; 13: 1–9
- Gardetto A et al. Reduction of Phantom Limb Pain and Improved Proprioception through a TSR-Based Surgical Technique: A Case Series of Four Patients with Lower Limb Amputation. Journal of Clinical Medicine, 2021; 10 (17): 4029
- Dumanian GA et al. Targeted Muscle Reinnervation Treats Neuroma and Phantom Pain in Major Limb Amputees: A Randomized Clinical Trial. Annals of Surgery, 2019; 270 (2): 238–246
- Valerio IL et al. Preemptive Treatment of Phantom and Residual Limb Pain with Targeted Muscle Reinnervation at the Time of Major Limb Amputation. Journal of the American College of Surgeons, 2019; 228 (3): 217–226
- Woo SL et al. Regenerative Peripheral Nerve Interfaces for the Treatment of Postamputation Neuroma Pain: A Pilot Study. Plastic and Reconstructive Surgery–Global Open, 2016; 4 (12): e1038
- Mauch JT, Kao DS, Friedly JL, Liu Y. Targeted muscle reinnervation and regenerative peripheral nerve interfaces for pain prophylaxis and treatment: A systematic review. Journal of Plastic, Reconstructive & Aesthetic Surgery, 2023; 75 (3): 948–959
- de Lange JWD et al. Prevention is better than cure: Surgical methods for neuropathic pain prevention following amputation – A systematic review. Journal of Plastic, Reconstructive & Aesthetic Surgery, 2022; 75 (3): 948–959
- Souza JM, Wade SM, Harrington CJ, Potter BK. Functional Limb Restoration Through Amputation: Minimizing Pain and Optimizing Function With the Use of Advanced Amputation Techniques. Annals of Surgery, 2021; 273 (3): e108–e113
- Sanders JE, Fatone S. Residual limb volume change: systematic review of measurement and management. Journal of Rehabilitation Research and Development, 2011; 48 (8): 949–986
- G. Vanghetti, Vitalizzazione delle membra artificiali: teoria e casistica dei motori plastici (chirurgia cinematica per protesi cinematica); con 137 illustrazioni. U. Hoepli, 1916
- Sauerbruch F. Chirurgische Vorarbeit für „Die willkürlich bewegbare künstliche Hand“. Medizinische Klinik, 1915; 11: 1125–1126
- Srinivasan SS et al. Neural interfacing architecture enables enhanced motor control and residual limb functionality postamputation. Proceedings of the National Academy of Sciences of the United States of America, 2021; 118 (9): e2019555118