Einleitung
In den letzten zwei Jahrzehnten hat sich das Bild eines typischen Patienten mit Querschnittlähmung erheblich gewandelt: Während vor 20 Jahren die Mehrzahl der Rückenmarkverletzungen traumatischen Ursprungs war, sind es heutzutage zunehmend nicht-traumatische Ursachen wie Entzündungen, Tumore oder degenerative Veränderungen der Wirbelsäule, die zu einer Querschnittlähmung führen. In Industrieländern wie Deutschland resultiert die Mehrzahl der frischen Querschnittlähmungen inzwischen aus nicht-traumatischen Rückenmarkschädigungen 1. Dies hat erhebliche Auswirkungen auf die Altersstruktur der etwa 2.000 Menschen, die jährlich in Deutschland eine Querschnittlähmung erleiden. Zunehmend tritt eine Zweigipfligkeit in der Altersverteilung der Betroffenen in den Altersklassen 18–30 und 60–75 Jahren auf; das mittlere Patientenalter bei Lähmungseintritt beträgt mittlerweile 60 Jahre 2. Auch hat sich der Anteil der Patienten mit Tetraplegie erhöht, der aktuell etwa 40 % des Gesamtkollektivs ausmacht. Der Trend hin zu nicht-traumatischen Läsionen, aber auch die Abnahme der Schwere von Unfällen hat zur Folge, dass bei der Mehrheit der Betroffenen eine inkomplette Lähmung mit noch erhaltenen Restfunktionen unterhalb der Läsionsstelle vorliegt.
Eine Rückenmarkschädigung führt zu Beeinträchtigungen sensibler, autonomer und motorischer Funktionen bis hin zu deren vollständigem Ausfall. Die Konsequenzen des Verlusts der Geh- und insbesondere der Greiffunktion auf die Teilhabe der Betroffenen am gesellschaftlichen Leben sind dramatisch. Für Hochgelähmte hat nachvollziehbarerweise die Verbesserung der Greiffunktion höchste Priorität. Da bis heute keine ursächliche Therapie der Rückenmarkschädigung existiert, sind es hauptsächlich rehabilitative Maßnahmen, die den Betroffenen zu mehr Selbstständigkeit verhelfen. Dabei wird das Rehabilitationsprinzip vorrangig vom Schweregrad der Lähmung bestimmt: Je kompletter die initiale Lähmungssituation ist, desto geringer sind die intrinsischen Erholungschancen und desto eher findet eine Versorgung mit Hilfsmitteln wie Rollstuhl, Orthesen oder Neuroprothesen zur Kompensation des dauerhaften Funktionsverlusts statt. Bei inkompletten Lähmungen mit noch erhaltenen Restfunktionen werden speziell in der frühen Phase nach Eintritt der Querschnittlähmung funktionsorientierte Therapien mit dem Ziel angewandt, eine bestmögliche Wiederherstellung der ursprünglichen Funktion zu erreichen. Dass dies möglich ist, liegt an der Plastizität des zentralen Nervensystems (ZNS), also der Fähigkeit zur Reorganisation von Nervenverbindungen. Auch das Rückenmark ist ein Teil des ZNS, das nicht nur Befehle vom Gehirn zu peripheren Nerven bzw. Muskeln weiterleitet, sondern ein zur Anpassung fähiges Interneuronennetzwerk im Zervikal- und Lumbalmark besitzt. Damit zielgerichtete Reorganisationsvorgänge in Gang gesetzt werden können, müssen Patienten Alltagsbewegungsaufgaben häufig ausführen. Eine aktive Beteiligung der Patienten ist dabei unerlässlich. Eine entscheidende Rolle spielt dabei die durch die Bewegungen ausgelöste sensible Rückmeldung vor allem von Muskelspindeln ins Rückenmark und ins ZNS 3.
Trainingssysteme zur Verbesserung der Gehfunktion
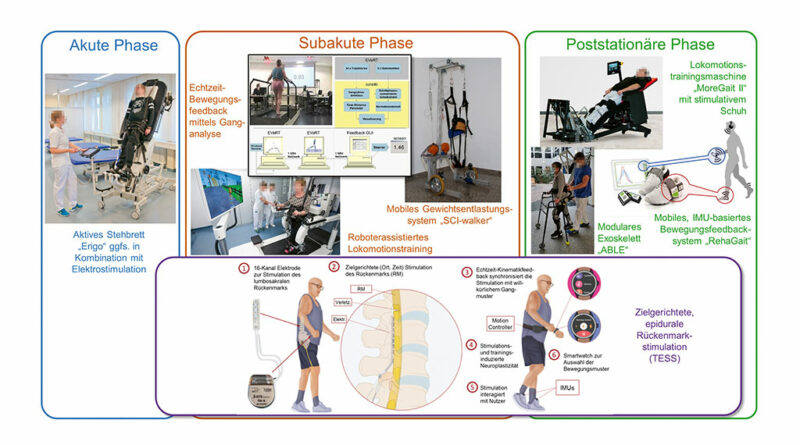
Bei der Durchführung funktionsorientierter Therapien, speziell dem Lokomotionstraining zur Verbesserung der Gehfunktion, werden inzwischen in allen Phasen der Rehabilitation routinemäßig Trainingsgeräte eingesetzt (Abb. 1). Die Komplexität und der Anwendungsbereich dieser Geräte unterscheiden sich erheblich und sollen im Folgenden genauer vorgestellt werden.
Laufbandtraining
Als Standardtherapie hat sich das manuell unterstützte Laufbandtraining unter teilweiser Entlastung des Körpergewichts („body weight supported treadmill training“, BWSTT) etabliert. In vielen wissenschaftlichen Studien konnte gezeigt werden, dass sich mit dieser Therapie nicht nur das Gangbild und die Ausdauer der Patientinnen und Patienten verbessern lassen, sondern dass dadurch auch die Spastik und die Unterstützung durch Gehhilfen reduziert werden können 4. Hierbei muss allerdings darauf hingewiesen werden, dass eine erhebliche Bandbreite der individuell erreichten Gehfunktionsverbesserungen vorliegt und in Einzelfällen auch bei intensivem Training keine Funktionsgewinne (non-responder) zu erreichen sind. Generell gilt der Grundsatz, dass eine einmal durch Training erreichte, ggfs. mit Hilfsmitteln unterstützte Gehfunktion im Langzeitverlauf erhalten bleibt.
Robotische Trainingsmaschinen
Da bei Patienten mit wenigen Restfunktionen bis zu drei Therapeuten zur manuellen Unterstützung der Gehbewegungen notwendig sind, haben in vielen Rehabilitationseinrichtungen robotische Lokomotionstrainingsmaschinen zur Entlastung der Therapeuten Einzug gehalten. Um bereits im frühen Stadium der Querschnittlähmung mit einem auf neurobiologischen Erkenntnissen zur Aktivierung des spinalen Gangprogramms basierenden Lokomotionstraining beginnen zu können, kommen Geräte zur Generierung physiologischer, sensibler Stimuli mit der Möglichkeit zur kreislaufangepassten Vertikalisierung zum Einsatz. Bei Patienten mit relativ guter Motorik, aber ausgeprägten (tiefen-)sensiblen Ausfällen kann ein instrumentiertes Bewegungsfeedbacktraining, bei dem den Patienten ihre Abweichung von einem physiologischen Gangbild in Echtzeit rückgemeldet wird, zur anhaltenden Normalisierung des Gangmusters beitragen 5 6.
Nach vielversprechenden Therapieerfolgen im Rahmen von Einzelfallstudien in der Anfangszeit konnte in Metaanalysen allerdings bisher kein Nachweis einer deutlichen therapeutischen Überlegenheit robotisch unterstützter Therapien im Vergleich mit einer konventionellen physiotherapeutischen Gangschulung gleicher Intensität erbracht werden 7. Die bisherigen Studien zeigen aber, dass eine hohe Trainingsintensität mit längeren Therapiezeiten 8 und über einen längeren Zeitraum ggfs. auch über den stationären Aufenthalt hinaus 9 zu einem besseren Therapieergebnis führen. Hierfür können robotische Trainingsmaschinen wirkungsvoll eingesetzt werden.
Über die letzten Jahrzehnte nimmt die Dauer der Erstbehandlung von Querschnittgelähmten und damit poststationär die Quantität und Qualität funktionsfördernder Therapien drastisch ab. Das Potenzial vieler vor allem älterer Betroffener bleibt damit ungenutzt. Daten aus der multizentrischen EMSCI-Studie (EMSCI = European Multicenter Study about Spinal Cord Injury, http://emsci.org) zeigen, dass ältere Menschen zwar grundsätzlich keine schlechtere neurologische Erholung zeigen, dass sie aber im Vergleich zu jüngeren Patienten mehr Zeit zu deren Umsetzung in verbesserte Alltagsfähigkeiten benötigen 10.
„MoreGait“-Prototyp
Einen Versuch zur Fortführung einer intensiven Lokomotionstherapie über den stationären Aufenthalt hinaus stellt der initial von der Universität Ulm und der Klinik für Paraplegiologie des Universitätsklinikums Heidelberg entwickelte „MoreGait“-Prototyp („MoreGait“ = „Motorized orthosis for home rehabilitation of gait“) dar. Herzstück des „MoreGait“ ist eine mechanische Fußsohlenstimulationseinheit („stimulativer Schuh“), mit der auch in einer sicheren halbaufrechten Trainingsposition ein weitgehend physiologisches Fußsohlenbelastungsmuster generiert werden kann. Eine schrittphasenbezogene Fußsohlenbelastung stellt einen wichtigen Reiz zur Anregung des lumbalen Interneuronennetzwerks dar. Die Ergebnisse einer Machbarkeitsstudie mit 25 chronischen, motorisch inkomplett Querschnittgelähmten zeigen, dass ein unbeaufsichtigtes, sicheres Heimtraining mit „MoreGait“ möglich ist und dass sich damit in acht Wochen Verbesserungen der Gehgeschwindigkeit und ‑ausdauer in der gleichen Größenordnung wie mit einer achtwöchigen stationären Therapie mit Großgeräten erzielen lassen 11.
Motorisierte Exoskelette
Eine weitere Möglichkeit für die selbstständige Fortführung eines Lokomotionstrainings stellen motorisierte Exoskelette dar, mit denen sich Betroffene auch in einer außerklinischen Umgebung fortbewegen können. Exoskelette eignen sich prinzipiell auch als Hilfsmittel zur Kompensation eines vollständigen Verlusts der Beinfunktion. Die aktuellen auf dem Markt befindlichen Systeme sind allerdings schwer, recht langsam, verschwinden nicht unter der Kleidung, und der Oberkörper muss zusätzlich durch Gehstützen oder einen Rollator stabilisiert werden. Aufgrund der Komplexität der Geräte ist deren Preis mit 80.000 bis 100.000 Euro außerordentlich hoch, sodass ein Privaterwerb kaum in Frage kommt. Einige Hersteller gehen deshalb den Weg des Downsizings, bei dem das Exoskelett auf die absolut notwendigen Komponenten reduziert ist. Ein Beispiel ist das Exoskelett „ABLE“, das aktuell (Stand: September 2021) im Rahmen eines vom Gesundheitsbereich des European Institute of Innovation and Technology (EIT) geförderten Projekts in Bezug auf Sicherheit und Gebrauchstauglichkeit im klinischen Umfeld getestet wird (https://clinicaltrials.gov/, Identifikationsnummer: NCT04876794). Bei positiven Ergebnissen ist im weiteren Verlauf eine ausgedehnte Heimanwendung geplant.
Solche Alltagsstudien sind dringend notwendig, vor allem auch, um die Langzeitfolgen der Exoskelett-Nutzung – zum Beispiel erhöhter Gelenkverschleiß oder andere Nebenwirkungen wie Stürze oder Druckstellen – zu untersuchen 12. Generell ist zudem der Kreis der potenziellen Exoskelett-Nutzer eingeschränkt, weil diese eine Reihe von Voraussetzungen erfüllen müssen, zu denen eine ausreichende Rumpfstabilität, uneingeschränkte passive Gelenkbeweglichkeit und wenig Spastik zählen.
Rückenmarkstimulation
Mit allen hier vorgestellten mechanischen Trainingsverfahren lässt sich früher oder später auch bei weiterer Intensivierung des Trainings kein zusätzlicher Funktionsgewinn erzielen. Deshalb werden Möglichkeiten erforscht, das Outcome funktionsorientierter Therapien durch Kombination mit pharmakologischen oder neuromodulatorischen Verfahren zu „boosten“. Ein besonders vielversprechendes Verfahren in diesem Zusammenhang stellt die Rückenmarkstimulation („spinal cord stimulation“, SCS) dar. Dabei werden über Oberflächen- oder – wesentlich selektiver – implantierte Epidural-Elektroden die sensiblen dorsalen Nervenwurzeln des Rückenmarks stimuliert und damit das lumbale spinale Interneuronennetzwerk angeregt, das für die Schrittmustergenerierung und ‑modulation verantwortlich ist. Erste Studienergebnisse zeigen, dass zumindest bei inkomplett Querschnittgelähmten ein relevanter zusätzlicher Funktionsgewinn durch die Kombination aus einer schrittphasengetriggerten, epiduralen SCS und einem intensiven, aufgabenspezifischen Therapieprogramm erreicht werden kann 13. Besonders erfreulich ist, dass es bei den Studienteilnehmern mit chronischer Querschnittlähmung zu Verbesserungen der Willkürfunktion nicht nur bei Nutzung der SCS, sondern darüber hinaus auch bei abgeschalteter Stimulation kam. Allerdings deuten die Daten auch darauf hin, dass die Therapieeffekte bei Menschen mit nur wenigen Restfunktionen deutlich geringer sind.
Assistenzsysteme zur Wiederherstellung der Greiffunktion
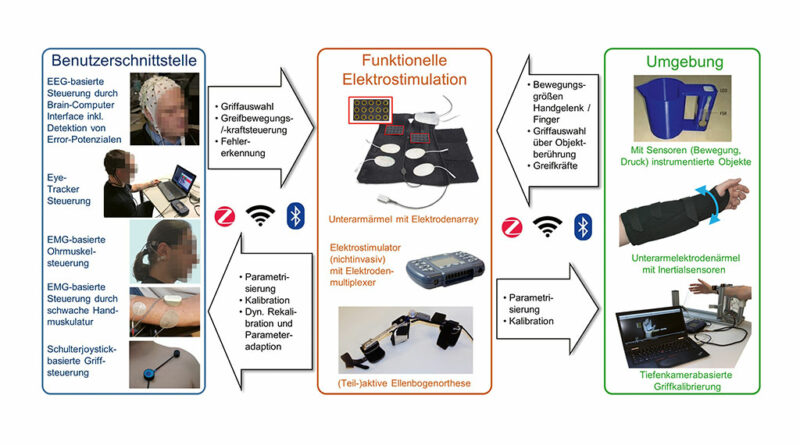
Bei Menschen mit Tetraplegie und vollständigem Funktionsverlust der Hände besitzt die Verbesserung der Greiffunktion höchste Priorität. Stehen noch genügend willkürlich vom Patienten kontrollierbare Arm- und Handmuskeln zur Verfügung, kann mit Nerven- und Muskeltransfers ein erheblicher Funktionsgewinn erzielt werden. Bei vollständig ausgefallener Greiffunktion, aber noch erhaltener Schulterfunktion und Ellenbogenbeugung (entspricht einem motorischen Lähmungsniveau von C5) kann aber nur mittels technischer Hilfen eine Funktionswiederherstellung erreicht werden. Liegt nur eine wenig ausgeprägte Zweitmotoneuronschädigung und damit ein geringer Grad der Denervation von Armmuskeln vor, können mittels Funktioneller Elektrostimulation (FES) zwei für Alltagsaufgaben wichtige Griffe (Schlüssel- und Zylindergriff) wiederhergestellt werden 14. Diese Griffmuster können mittels sieben Oberflächenelektroden auf dem Unterarm erzeugt werden, die zur besseren Handhabung in einen individualisiert hergestellten Elektrodenärmel eingearbeitet werden (Abb. 2). Ist zusätzlich zur Hand- auch die Ellenbogenfunktion substantiell eingeschränkt, kann diese mit einer externen, aktiven Orthese (Hybrid-FES-Orthese) wiederhergestellt werden. Eine vollständige Unterstützung der Ellenbogenflexion mittels FES ist jedoch nur kurzfristig möglich, weil die nichtphysiologische Aktivierung der Oberarmmuskulatur aufgrund des großen Kraftbedarfs und der Notwendigkeit einer Dauerstimulation zur Aufrechterhaltung einer bestimmten Position innerhalb weniger Minuten zu einer starken Ermüdung führt. Bei individueller Anpassung aller Komponenten kann mittels Neuroprothesen nach Abschluss eines vorbereitenden Muskeltrainings ein deutlicher Kraft- und vor allem Funktionszuwachs erreicht werden 15.
Allerdings besteht für einen routinemäßigen Alltagseinsatz nichtinvasiver Greifneuroprothesen großer Verbesserungsbedarf hinsichtlich Stabilität und Reproduzierbarkeit der generierten Griffmuster. Der Grund hierfür liegt in Elektrodenverschiebungen, die beim Anziehen des Elektrodenhandschuhs und bei Bewegungen auftreten. Zur Lösung dieses vor allem bei der Stimulation der kleinen Muskelgruppen des Daumens auftretenden Problems wurden im EU-Projekt „MoreGrasp“ (http://moregrasp.eu) Multielektrodenarrays (60 × 35 mm, 5 × 3 Elektroden mit 5 mm Durchmesser und 5 mm Abstand) aus leitfähigem Silikon entwickelt 16. Die Einzelelektroden des Arrays können mittels eines Multiplexers zu größeren Elektroden zusammengeschaltet werden, die dann innerhalb des Arrays elektronisch verschoben werden können. Damit kann der Stimulationsort nicht nur statisch nach dem Anlegen des Unterarmelektrodenhandschuhs, sondern auch dynamisch bei Rotation der Hand korrigiert werden. Letzteres ist besonders wichtig, um einen plötzlichen Kraftverlust nach Ergreifen eines Gegenstands zu vermeiden. Das Potenzial der Multiarrayelektrodentechnologie kann allerdings nur dann voll ausgeschöpft werden, wenn die Möglichkeit zur (teil-)automatisierten Kalibrierung besteht. Bei diesem Kalibrationsvorgang werden die optimalen Elektrodenpositionen für jedes Greifmuster auf der Basis klinischen Vorwissens in vordefinierten Handgelenkstellungen (Pronation, Neutralstellung, Supination) unter Verwendung verschiedenartiger Sensoren (Druck‑, Kraft‑, Beschleunigungssensoren, Tiefenkameras) bestimmt. Diese Informationen können dann später in Closed-Loop-Algorithmen zur automatischen Kontrolle der durch die Greifneuroprothese generierten Greifmuster und zur Anpassung der Stimulationsparameter verwendet werden.
Benutzerschnittstellen von Assistenzsystemen
Die Mensch-Maschine Schnittstelle (Human-Machine Interface, HMI) trägt maßgeblich zur Nutzerakzeptanz jeglicher technischer Assistenzsysteme und im Speziellen von Neuroprothesen bei. Die Vision eines „perfekten“ HMIs besteht in einer vollständig intuitiven Bedienung. Um Neuroprothesennutzern eine intuitivere Steuerung zu ermöglichen, stellt die Steuerung über eine Gehirn-Computer Schnittstelle (Brain-Computer Interface, BCI) zur Detektion der Bewegungsintention direkt am Entstehungsort einen vielversprechenden Ansatz dar. Dies gilt besonders für Hochquerschnittgelähmte, bei denen oft nur wenige Eingabemöglichkeiten für ein HMI existieren. Aktuell sind Hybrid-BCIs (hBCIs) am aussichtsreichsten für eine Alltagsnutzung 17. Bei solchen hBCIs wird ein BCI mit etablierten HMIs kombiniert, zu denen Joysticks, myoelektrische Schnittstellen zur Ableitung der Aktivität von nicht durch die Lähmung betroffenen Muskeln 18 oder Eye-Tracker 19 gehören. Auch andere aus dem Elektroenzephalogramm (EEG) extrahierte Signale wie Fehlerpotenziale 20 können mit dem BCI kombiniert werden.
Durch die Verwendung eines hBCIs bestehend aus einem auf Bewegungsvorstellungen basierenden nichtinvasiven BCI und einem Schulterpositionssensor konnte zum ersten Mal gezeigt werden, dass die Kontrolle einer nichtinvasiven Greif- und Ellenbogenneuroprothese prinzipiell möglich ist (Abb. 3) 21. Bis zu einer Alltagsanwendung ist es aber aufgrund der hohen Zahl falsch erkannter Schaltbefehle des BCIs und der aufwendigen Handhabung der Arm-FES-Orthese noch ein weiter Weg. Damit nichtinvasive Neuroprothesen im Alltag funktionieren können, muss neben den Elektrodenpositionen, dem Elektrodenhandschuh und den Orthesenkomponenten auch die Benutzerschnittstelle an die individuellen Wünsche und Gegebenheiten des Nutzers angepasst werden.
Obwohl potenzielle BCI-Nutzer nichtinvasive Systeme bevorzugen 22, lassen sich mit invasiven Systemen aufgrund der höheren Signalqualität und Selektivität deutlich bessere Ergebnisse im Hinblick auf eine intuitive Kontrolle erzielen. Unter Verwendung intrakortikaler Mikro-Elektrodenarrays, die chirurgisch in den Motorkortex eingebracht werden müssen, ist die simultane Steuerung von bis zu zehn Freiheitsgraden eines Roboterarms möglich 23. Eine ähnliche Performance scheint beim aktuellen Stand mit nichtinvasiven BCIs unerreichbar. Allerdings bestehen bei den intrakortikalen Elektroden große Probleme mit der Langzeitstabilität, die momentan weniger als 5 Jahre beträgt. Darüber hinaus muss der Computeralgorithmus, der die Bewegungsintentionen des Nutzers aus den Ableitungen der Feuerungsrate der Neurone identifiziert, täglich neu durch technische Experten angelernt werden. Grund dafür ist, dass zwei Drittel der Neurone über Nacht schlicht „vergessen“, wie sie den Roboterarm am Vortag gesteuert haben. Hier ist noch viel Grundlagenforschung notwendig, um die neuronalen Mechanismen genauer zu verstehen. Möglicherweise bewirkt die Rückmeldung von Bewegungsinformationen mittels Elektrostimulation des sensiblen Kortex eine Stabilisierung der Lerneffekte 24. Ein möglicher Kompromiss zwischen Performance und Invasivität könnte ein auf den Kortex aufgelegter Verstärker für die Aufzeichnung und drahtlose Übermittlung des Elektrokortikogramms darstellen 25. In einer Einzelfallstudie konnte jedenfalls die Steuerung von 4 × 2 Freiheitsgraden eines beidarmigen Exoskeletts erfolgreich gezeigt werden, wobei über mehrere Wochen kein neues Anlernen des Bewegungsdekodierungsalgorithmus notwendig war.
Fazit
In der Gangrehabilitation von inkomplett Querschnittgelähmten haben sich inzwischen eine Reihe von robotischen Lokomotionstrainingssystemen in der klinischen Routine etablieren können. Allerdings konnte bisher keine deutliche therapeutische Überlegenheit der gerätegestützten Therapien nachgewiesen werden. Dies ist nicht weiter verwunderlich, da Lokomotionsroboter im Wesentlichen das durch Therapeuten durchgeführte Training nachahmen. Allerdings zeichnet sich ab, dass mit kombinatorischen Ansätzen aus intensiver funktionsorientierter, robotischunterstützter Therapie und neuartigen neuromodulatorischen Verfahren wie der Elektrostimulation des lumbosakralen Rückenmarks in Zukunft deutlich größere Funktionsgewinne erreicht werden können.
Bei Hoch-Querschnittgelähmten mit stark beeinträchtigter Greiffunktion stehen zumindest im Forschungsumfeld einige vielversprechende Ansätze in Form von Neuroprothesen oder über Gehirnsignale gesteuerte Roboterarme zur Verfügung, mit denen der Funktionsverlust zumindest teilweise ausgeglichen werden kann. Allerdings müssen diese komplexen Technologien ihre Alltagstauglichkeit und ihren Nutzen noch unter Beweis stellen.
Dennoch geben die in diesem Beitrag vorgestellten Forschungsarbeiten auf dem Gebiet der Neurotechnologie und der technischen Assistenzsysteme berechtigten Anlass zu der Hoffnung, dass in Zukunft eine Querschnittlähmung zwar nicht geheilt werden kann, dass aber dennoch eine verbesserte Rehabilitation und damit ein selbstbestimmteres Leben möglich sein werden.
Der Autor:
Priv.-Doz. Dr.-Ing. Rüdiger Rupp
Sektionsleiter Experimentelle
Neurorehabilitation
Klinik für Paraplegiologie
Universitätsklinikum Heidelberg
Schlierbacher Landstr. 200a
69118 Heidelberg
ruediger.rupp@med.uni-heidelberg.de
Begutachteter Beitrag/reviewed paper
Rupp R. Technische Assistenzsysteme für die motorische Rehabilitation von Menschen mit Querschnittlähmung. Orthopädie Technik, 2021; 72 (9): 36–42
- Deutschsprachige Gesellschaft für Paraplegiologie e. V., Deutsche Stiftung Querschnittlähmung, Deutscher Rollstuhl-Sportverband, Fördergemeinschaft der Querschnittgelähmten in Deutschland e.V. Pressemappe Querschnittlähmung. http://dmgp.de/images/presse/DMGP-DRS-DSQ-FGQ-Pressemappe_online.pdf (Zugriff am 23.06.2021)
- Deutschsprachige Gesellschaft für Paraplegiologie e. V., Deutsche Stiftung Querschnittlähmung, Deutscher Rollstuhl-Sportverband, Fördergemeinschaft der Querschnittgelähmten in Deutschland e.V. Pressemappe Querschnittlähmung. http://dmgp.de/images/presse/DMGP-DRS-DSQ-FGQ-Pressemappe_online.pdf (Zugriff am 23.06.2021)
- Takeoka A, Vollenweider I, Courtine G, Arber S. Muscle spindle feedback directs locomotor recovery and circuit reorganization after spinal cord injury. Cell, 2014; 159: 1626–1639
- Hicks AL, Ginis KA. Treadmill training after spinal cord injury: it’s not just about the walking. J Rehabil Res Dev, 2008; 45: 241–248
- Schliessmann D, Schuld C, Schneiders M, Derlien S, Glockner M, Gladow T, Weidner N, Rupp R. Feasibility of visual instrumented movement feedback therapy in individuals with motor incomplete spinal cord injury walking on a treadmill. Front Hum Neurosci, 2014; 8: 416
- Schliessmann D, Nisser M, Schuld C, Gladow T, Derlien S, Heutehaus L, Weidner N, Smolenski U, Rupp R. Trainer in a pocket – proof-of-concept of mobile, realtime, foot kinematics feedback for gait pattern normalization in individuals after stroke, incomplete spinal cord injury and elderly patients. J Neuroeng Rehabil, 2018; 15: 44
- Mehrholz J, Harvey LA, Thomas S, Elsner B. Is bodyweight-supported treadmill training or robotic-assisted gait training superior to overground gait training and other forms of physiotherapy in people with spinal cord injury? A systematic review. Spinal Cord, 2017; 55: 722–729
- Wirz M, Mach O, Maier D, Benito-Penalva J, Taylor J, Esclarin A, Dietz V. Effectiveness of Automated Locomotor Training in Patients with Acute Incomplete Spinal Cord Injury: A Randomized, Controlled, Multicenter Trial. J Neurotrauma, 2017; 34: 1891–1896
- Hicks AL, Adams MM, Martin Ginis K, Giangregorio L, Latimer A, Phillips SM, McCartney N. Long-term bodyweight-supported treadmill training and subsequent follow-up in persons with chronic SCI: effects on functional walking ability and measures of subjective well-being. Spinal Cord, 2005; 43: 291–298
- Wirz M, Dietz V, European Multicenter Study of Spinal Cord Injury. Recovery of sensorimotor function and activities of daily living after cervical spinal cord injury: the influence of age. J Neurotrauma, 2015; 32: 194–199
- Rupp R, Schliessmann D, Plewa H, Schuld C, Gerner HJ, Weidner N, Hofer EP, Knestel M. Safety and efficacy of at-home robotic locomotion therapy in individuals with chronic incomplete spinal cord injury: a prospective, pre-post intervention, proof-of-concept study. PLoS One, 2015; 10: e0119167
- Benson I, Hart K, Tussler D, van Middendorp JJ. Lower-limb exoskeletons for individuals with chronic spinal cord injury: findings from a feasibility study. Clin Rehabil, 2016; 30: 73–84
- Wagner FB, Mignardot JB, Le Goff-Mignardot CG, Demesmaeker R, Komi S, Capogrosso M, Rowald A, Seanez I, Caban M, Pirondini E, et al: Targeted neurotechnology restores walking in humans with spinal cord injury. Nature, 2018; 563: 65–71
- Rupp R, Franz S, Berberich M, Rohm M, Schneiders M, Hessing B, Weidner N, Müller-Putz GR. Ich (be)greife, also bin ich – Möglichkeiten und Herausforderungen nichtinvasiver Greifneuroprothesen für Hoch-Querschnittgelähmte. Orthopädie Technik, 2016; 67 (5): 56–61
- Rupp R, Franz S, Berberich M, Rohm M, Schneiders M, Hessing B, Weidner N, Müller-Putz GR. Ich (be)greife, also bin ich – Möglichkeiten und Herausforderungen nichtinvasiver Greifneuroprothesen für Hoch-Querschnittgelähmte. Orthopädie Technik, 2016; 67 (5): 56–61
- Müller-Putz GR, Schwarz A, Pereira J, Ofner P, Hessing B, Schneiders M, Stein S, Ramsay A, Williamson JH, Murray-Smith R, et al. Non-invasive Brain-Computer Interfaces for control of grasp neuroprosthesis – The European MoreGrasp Initiative. In: Müller-Putz GR, Rupp R (Hrsg.). Neuroprosthetics and Brain-Computer Interfaces in Spinal Cord Injury. Cham: Springer Nature; 2021: 307–352
- Müller-Putz GR, Leeb R, Tangermann M, Höhne J, Kübler A, Cincotti F, Mattia D, Rupp R, Müller KR, del R. Millan J. Towards Noninvasive Hybrid Brain-Computer Interfaces: Framework, Practice, Clinical Application, and Beyond. Proceedings of the IEEE, 2015; 103: 926–943
- Schmalfuss L, Hahne J, Farina D, Hewitt M, Kogut A, Doneit W, Reischl M, Rupp R, Liebetanz D. A hybrid auricular control system: direct, simultaneous, and proportional myoelectric control of two degrees of freedom in prosthetic hands. J Neural Eng, 2018; 15: 056028
- Hoffmann K‑P, Olze H, Kneist W, Schiemer JF, Krüger T, Somerlik-Fuchs KH, Gottschalk M, Kostelnik J, Schreivogel A, Ruff R, et al. Technical, Medical and Ethical Challenges in Networks of Smart Active Implants. Proceeedings of the 41st IEEE International Conference of the Engineering in Medicine and Biology Society (EMBC), Berlin, 2019; 1484–1487
- Lopes-Dias C, Sburlea AI, Breitegger K, Wyss D, Drescher H, Wildburger R, Muller-Putz GR. Online asynchronous detection of error-related potentials in participants with a spinal cord injury using a generic classifier. J Neural Eng, 2021; 18: 046022
- Rohm M, Schneiders M, Müller C, Kreilinger A, Kaiser V, Müller-Putz GR, Rupp R. Hybrid brain-computer interfaces and hybrid neuroprostheses for restoration of upper limb functions in individuals with high-level spinal cord injury. Artificial Intelligence in Medicine, 2013; 59: 133–142
- Collinger JL, Boninger ML, Bruns TM, Curley K, Wang W, Weber DJ. Functional priorities, assistive technology, and brain-computer interfaces after spinal cord injury. J Rehabil Res Dev, 2013; 50: 145–160
- Wodlinger B, Downey JE, Tyler-Kabara EC, Schwartz AB, Boninger ML, Collinger JL. Ten-dimensional anthropomorphic arm control in a human brain-machine interface: difficulties, solutions, and limitations. J Neural Eng, 2015; 12: 016011
- Hughes C, Herrera A, Gaunt R, Collinger J. Bidirectional brain-computer interfaces. Handb Clin Neurol, 2020; 168: 163–181
- Benabid AL, Costecalde T, Eliseyev A, Charvet G, Verney A, Karakas S, Foerster M, Lambert A, Moriniere B, Abroug N, et al. An exoskeleton controlled by an epidural wireless brain-machine interface in a tetraplegic patient: a proof-of-concept demonstration. Lancet Neurol, 2019; 18: 1112–1122