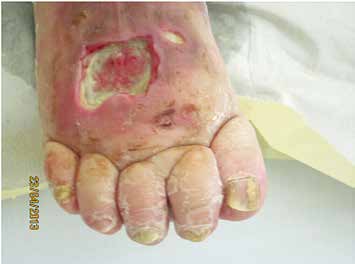
Einleitung
Bei Wunden unterscheidet man akute und chronische Wunden. Im Gegensatz zu einer akuten Wunde, die meist ohne Komplikation abheilt, erzeugen chronische Wunden eine Vielzahl von Problemen, die die Wundheilung verzögern oder sogar verhindern. Eine Wunde, die trotz kausaler und fachgerechter lokaler Behandlung innerhalb von 8 bis 12 Wochen keine deutliche Heilungstendenz aufweist, wird als chronisch bezeichnet.
Im Gegensatz zu akuten Wunden gibt es bei chronischen Wunden viele Störfaktoren, die eine Wundheilung behindern. Diese Störfaktoren können sowohl lokal – also direkt an der Wunde – oder systemisch – den ganzen Körper betreffend – auftreten. Wichtige Voraussetzungen einer erfolgreichen Wundheilung sind eine gründliche Anamnese und eine Wunddiagnose, damit die Ursache der Wunde mittherapiert werden kann.
Grunderkrankungen und Wundarten
Periphere arterielle Verschlusskrankheit (pAVK)
Bei pAVK 1 2 handelt es sich um einen Oberbegriff für Verengungen oder Verschlüsse der arteriellen Gefäße. Durch die Minderversorgung meist an den Beinen kommt es zu einem Mangel an Sauerstoff und Nährstoffen. Dadurch entstehen vor allem bei Belastung Wadenkrämpfe und Schmerzen. Der Betroffene bleibt stehen, die Symptome verbessern sich bis zur nächsten Belastung. Die Gehstrecken, die ohne Beschwerden bewältigt werden können, werden immer kürzer – bis zum Auftreten von Ruheschmerzen. Bekannt ist dieses Symptom auch unter der Bezeichnung Claudicatio intermittens (Schaufensterkrankheit). Letztlich kommt es zum Absterben von Zellen. Sichtbare Zeichen sind ein blasser, kalter und livide verfärbter Fuß mit dünner pergamentartiger Haut. Es fehlt die Behaarung, die Fußpulse sind nicht tastbar.
Bei der Anamnese ist die Erfassung der Risikofaktoren wichtig, dazu gehören z. B. Bluthochdruck, Fettstoffwechselstörungen und ein möglicher Nikotinabusus – um nur einige Faktoren zu nennen. Wird die Durchblutungssituation durch einen Eingriff wie z. B. eine PTA (perkutane transluminale Angioplastie) oder durch eine gefäßchirurgische Operation nicht verbessert, kann trotz aller Bemühungen die Wundheilung nicht fortschreiten. Entsteht nun – meist durch ein Bagatelltrauma – eine Verletzung, kann der Körper dem nur wenig an Heilung entgegensetzen. Dann entsteht möglicherweise ein sogenanntes Ulcus cruris arteriosum. Der Schweregrad wird nach Fontaine klassifiziert.
Chronisch-venöse Insuffizienz (CVI)
Bei der CVI 3 4 hingegen kommt es durch eine Veneninsuffizienz zu einem gestörten Rücktransport des Blutes aus den Beinen zum Herzen. Das Blut staut sich in den tiefen Venen. Schwere Beine, das Auftreten eines Spannungsgefühls und Ödeme im Bereich der Sprunggelenke sind oft die ersten bemerkbaren Symptome. Sichtbar sind auch eine bräunlich-rote Hyperpigmentierung der Haut sowie ein trockenes, schuppendes und rissiges Hautbild. Auch hier ist eine Anamnese zur Ermittlung der Risikofaktoren wie z. B. Übergewicht, sitzende oder stehende Tätigkeit, Schwangerschaft, tiefe Beinvenenthrombosen oder Phlebitiden zielführend. Es muss ermittelt werden, ob ein venenchirurgischer Eingriff die Situation verbessern kann oder ob das Tragen von Kompressionsstrümpfen bzw. die fachgerechte Anlage eines Kompressionsverbandes ausreichend ist. Beim Auftreten einer Wunde spricht man von einem Ulcus cruris venosum, die Einteilung erfolgt nach Widmer.
Dekubitus
Ein Dekubitus 5 6 tritt meist bei Menschen mit eingeschränkter Mobilität oder bei bettlägerigen Patienten auf. Hierbei kommt es über einen längeren Zeitraum zu einem erhöhten Druck an einer Stelle – meist über einem knöchernen Vorsprung. Des Weiteren begünstigen Reibe- und Scherkräfte, wie sie etwa beim Transfer vom Bett in einen Stuhl entstehen können, Mikroverletzungen im Gewebe. Die Höhe des Drucks und die Zeitspanne, in der er besteht, sowie die individuellen Risikofaktoren des Patienten entscheiden über das Ausmaß der Schädigung.
Eine frühzeitige Risikoeinschätzung mittels einer geeigneten Skala, meist der Braden-Skala, ist hilfreich, frühzeitig die richtigen Maßnahmen zu planen. Durch den erhöhten Druck kommt es zu einer Minderdurchblutung und zu einer verschlechterten Versorgung der Zellen mit Sauerstoff. Auch dies führt nach einer gewissen Zeit zum Absterben der Zellen. Erkennbar wird dies oft an einer Rötung, die sich nicht wegdrücken lässt. Kann der Patient nicht alleine seine Position verändern und/oder erhält er keine Hilfestellung für eine neue Positionierung, kommt es zum Absterben von Gewebe – ein Dekubitus entsteht. An der Hautoberfläche ist oft nur die Spitze des Eisberges zu sehen – inwieweit das Gewebe in der Tiefe geschädigt ist, kann man oft erst im weiteren Verlauf erkennen. Hier kann nur durch eine frühzeitige, komplette und konsequente Druckentlastung der betroffenen Stelle gegengesteuert werden.
Die Einteilung der Gewebeschädigung erfolgt anhand des „Expertenstandards Decubitusprophylaxe in der Pflege” 7. Die Abgrenzung zu einer inkontinenzassoziierten Dermatitis (IAD) bedarf der Personalschulung.
Diabetischer Ulcus
Beim diabetischen Ulcus 8 9 kommt es aufgrund einer Folgeerkrankung des Diabetes mellitus zu einer Polyneuropathie und damit zu einer Veränderung des Gangbildes sowie zu einer Verformung des Fußskelettes. Diese beiden Faktoren führen zu einer veränderten Belastung der Füße beim Gehen. Dies ist oft noch mit einer pAVK kombiniert. Ein weiterer Faktor, der durch eine Polyneuropathie ausgelöst wird, ist eine veränderte oder ganz fehlende Schmerzwahrnehmung der Betroffenen. Oft spüren diese nicht, „wenn oder wo der Schuh drückt”. Zusammen mit der veränderten Fußform (breiter, Fußgewölbe senkt sich ab) entstehen Ulcerationen. Da diese keine Schmerzen verursachen, werden diese Verletzungen oft verharmlost. Die Betroffenen suchen somit oft viel zu spät einen Arzt auf. Eine inkonsequente Versorgung des Ulcus, verbunden mit der erhöhten Infektionsgefahr und einer pAVK, können bis zur Amputation des betroffenen Beines führen.
Während der Behandlung ist es wichtig, die Blutzuckereinstellung wenn nötig zu optimieren und abzuklären, wie die arterielle Durchblutungssituation sich darstellt. Ein weiterer Schwerpunkt ist hierbei die Schuhversorgung: Der Betroffene muss speziell für ihn durch einen Orthopädie-Schuhtechniker maßangefertigte Schuhe tragen. Bei der Einteilung des diabetischen Ulcus wird die Klassifizierung nach Wagner/Armstrong verwendet.
Wundheilungsphasen
Auch ein adäquates Fachwissen im Bereich Wundheilung ist für die lokale Behandlung der Wunde wichtig. Oft bleibt die Heilung in einer der drei Wundheilungsphasen – Exsudationsphase, Granulationsphase und Epithelisierungsphase – stecken oder verschlechtert sich sogar. Zudem sind bei einer chronischen Wunde oft mehrere Phasen gleichzeitig vorhanden. Die Phasen im Einzelnen:
Exsudationsphase
Die Exsudationsphase 10 (Reinigungsphase), auch inflammatorische Phase genannt, zeichnet sich durch eine vermehrte Exsudation aus. Dadurch sollen Bakterien, Zelltrümmer und Schmutz aus der Wunde gespült werden. Entsteht eine Verletzung an Haut und Gewebe unter Beteiligung der Blutgefäße, leitet der Körper unmittelbar die Blutgerinnung durch eine sogenannte Vasokonstriktion (Engstellung der Gefäße) ein. Durch Thrombozytenaggregation wird das Blutgefäß abgedichtet. Der Einsatz von Makrophagen (Fresszellen) unterstützt am Ort des Geschehens die Immunabwehr. Sichtbar an der Wunde in dieser Wundheilungsphase sind ein Blutpfropf, Schorf und viel Wundexsudat.
Granulationsphase
Die Granulationsphase 11 beginnt bereits am 2. Tag nach der Wundentstehung. Die Angiogenese (das Einsprossen neuer Blutgefäße) beginnt, darüber bildet sich neues Granulationsgewebe. Auf der Wunde sichtbar wird ein dunkelrotes, feuchtglänzendes Granulationsgewebe von körniger Struktur. Dieses „neue Gewebe” ist sehr empfindlich vor allem gegenüber mechanischen Belastungen.
Epithelisierungsphase
Die dritte Wundheilungsphase ist die Epithelisierungsphase 12 oder reparative Phase. Hierbei kommt es zu einer Wundkontraktion. Das Granulationsgewebe verliert Wasser und zieht sich etwas zurück. Durch die Bildung von Kollagenfasern entsteht Narbengewebe, mit dem die Wunde bis auf Hautniveau aufgefüllt wird. Vom Wundrand aus wandern Epithelzellen über das Granulationsgewebe ein. Nach dem Verschluss der Wunde dauert es bis zu 8 Wochen, bis das Gewebe seine maximale Belastbarkeit erreicht hat. Es handelt sich hierbei aber immer um Ersatz- oder Narbengewebe, das niemals die Belastbarkeit des ursprünglichen Gewebes erreicht. Die abgeheilte Wunde, unabhängig davon, welche Grunderkrankung zugrunde liegt, erfordert immer eine gute Beobachtung und Pflege, um das Auftreten eines Rezidivs frühzeitig zu erkennen oder es sogar ganz zu verhindern.
Wundreinigung – welche Möglichkeiten gibt es?
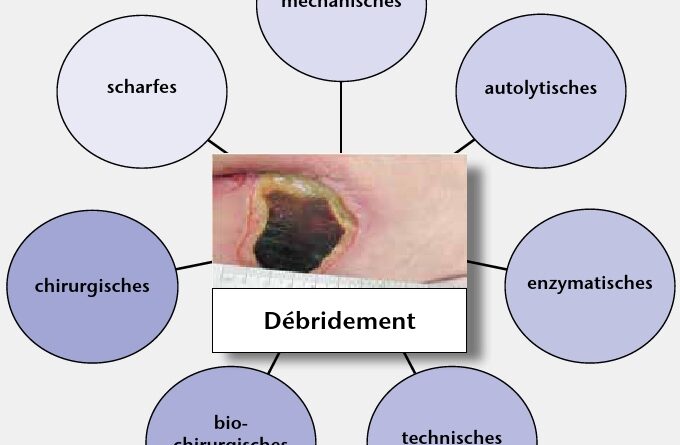
Für die Wundreinigung 13 14 bei chronischen Wunden gibt es verschiedene Bezeichnungen: Wunddébridement, Wundbettvorbereitung, Wundtoilette oder „wound bed preparation”. Alle aufgeführten Bezeichnungen implizieren eine gründliche Reinigung, hinter dem Begriff „Débridement” steht die Entfernung nicht vitalen Gewebes aus der Wunde. Aus der Wunde soll alles entfernt werden, was sie beim Abheilen behindert. Dazu gehören Nekrosen, Schorf, Fibrin, Bakterien, Toxine, geschädigtes Gewebe, Biofilm, Eiter, Hämatome, Detritus sowie Fremdkörper, wozu auch Reste von Verbandstoffen und Hyperkeratosen gehören.
Durch die Wundreinigung sollen zumindest die lokalen Störfaktoren der Wundheilung reduziert oder ganz entfernt werden. Weitere Faktoren, die für eine Wundreinigung sprechen: weniger Wundgeruch, eine verringerte Infektionsgefahr sowie eine Erleichterung des Exsudatmanagements. Gleichzeitig bedeutet dies auch eine Verbesserung der Lebensqualität für den Patienten und hat somit hohe Priorität. Die verschiedenen Möglichkeiten der Wundreinigung werden im Folgenden genauer vorgestellt (Abb. 1):
Mechanisches Débridement
Hierbei handelt es sich um eine einfache Methode, die überall angewendet werden kann. Die Wunde wird dabei mit einer sterilen, feuchten Gazekompresse ausgewischt. Dies kann durch eine vorhergehende Nassphase unterstützt werden. Das Ablösen der Beläge geht nur langsam voran, wenig Erfolg gibt es bei harten Nekrosen auf dem Wundgrund. Für den Patienten ist dieses Auswischen oft mit Schmerzen verbunden. Neue Produkte auf dem Markt wie Debrisoft® oder UCS® Debridement sollen hier weniger Schmerzen verursachen. Durch die spezielle Herstellung dieser Wundreinigungsprodukte kommt es zu einem besseren Abtragen der unerwünschten Beläge in der chronischen Wunde und somit zu einem schnelleren Erreichen eines sauberen Wundgrundes.
Autolytisches Débridement
Bei dieser Methode kommen meistens Hydrogele oder sogenannte Nasstherapeutika zum Einsatz. Durch die Feuchtigkeit kommt es zu einem Aufweichen der Nekrosen und Beläge – diese können dann beim nächsten Verbandswechsel besser entfernt werden. Diese Methode eignet sich auch gut, um ein scharfes Débridement vorzubereiten. Auch der Einsatz dieser Variante ist überall möglich und verursacht wenig Schmerzen beim Patienten. Allerdings ist diese Methode zeitaufwendig, es besteht die Gefahr einer Mazeration des Wundrandes; sie ist für infizierte Wunden nicht geeignet.
Enzymatische Wundreinigung
Hierbei werden enzymhaltige Salben oder Gels in die Wunde gebracht und mit einem Sekundärverband bedeckt. Dies bewirkt ein Andauen der Nekrosen und Beläge und funktioniert nur, wenn genügend Wundexsudat – also Feuchtigkeit – vorhanden ist. Auch Art und Zusammensetzung des nekrotischen Gewebes sind wichtig für die Auswahl des Präparates. Die Enzyme arbeiten allerdings nicht sehr selektiv – sie dauen auch gesundes Gewebe an. Da der Verband angesichts der kurzen Wirksamkeit der Enzyme und des Auftretens großer Mengen an Wundexsudat oft zweimal täglich erneuert werden muss, ist dies ein personalintensives Verfahren. Zudem besteht die Gefahr von Allergien. Für die richtige Anwendung auf der Wunde müssen die Herstellerangaben beachtet werden.
Scharfes Débridement
Diese Methode ist eine Art des chirurgischen Débridements, aber deutlich günstiger. Sie kann überall nach entsprechender Vorbereitung eingesetzt werden. Hierbei werden mit einer Ringkürette oder einem Skalpell Nekrosen und Beläge entfernt. Dies ist eine schnelle und kostengünstige Methode. Allerdings kann sie für den Patienten schmerzhaft sein und sollte nur unter lokaler Anästhesie und systemischer Schmerzmittelgabe durchgeführt werden. Hierbei ist die Schmerzstärke vom Patienten zu erfragen und entsprechend zu berücksichtigen.
Wird lokal Emla®-Salbe verwendet, muss die Einwirkdauer von 30 bis 45 Minuten beachtet werden. Hieran wird erkennbar, dass auch ein adäquates Zeitmanagement zum Gelingen eines Débridements beiträgt. Der Einsatz dieser Methode kann sowohl ambulant als auch im Krankenhaus oder Pflegeheim am Krankenbett erfolgen.
Chirurgisches Débridement
Unter OP-Bedingungen und Narkose erfolgt eine schnelle und gründliche Reinigung der Wunde ohne Schmerzen für den Patienten. Bei diesem invasiven Verfahren wird mit einem Eingriff alles, was die Wundheilung lokal stört, entfernt. Es entsteht somit eine „saubere” Wundfläche mit den besten Voraussetzungen für eine Abheilung. Auch die Möglichkeit der Blutstillung ist hierbei sichergestellt. Diese Methode eignet sich gut für infizierte Wunden, für Wunden, bei denen das Ausmaß in die Gewebetiefe unklar ist, oder bei einer Beteiligung von Knochen und Gelenken. Hierbei entstehen allerdings hohe Kosten, und der Patient muss sich in einem „narkose- und operationsfähigen Allgemeinzustand” befinden.
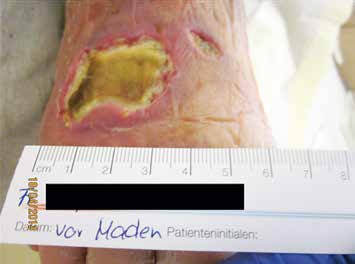
Biochirurgisches Débridement
Hierbei handelt es sich um eine sehr alte Art, Wunden zu reinigen. Bereits Ambroise Paré (1509–1590) hat die „Madentherapie” in seinem Lazarett angewendet. Allerdings gab es damals im Gegensatz zu heute keine steril gezüchteten Maden. Heute wird für dieses Verfahren meist der Begriff „Biochirurgie” verwendet, um eine bessere Akzeptanz bei Patienten und Personal zu erlangen.
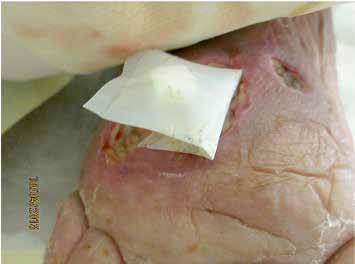
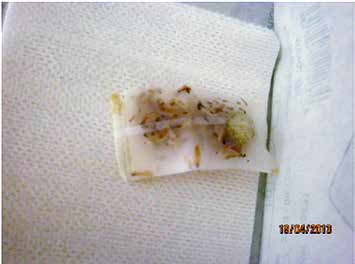
Dabei kommen steril gezüchtete Maden der Fliegenart Lucilia sericata zum Einsatz. Die Maden werden als sogenannte Freiläufer oder im Biobag (diesen kann man sich wie einen Teebeutel – mit kleinen Maden gefüllt – vorstellen) vertrieben (Abb. 2a–d).
Die Maden geben Sekret in die Wunde ab, dabei wird avitales Gewebe verflüssigt, das die Maden aufschlürfen. Neue Forschungen beschäftigen sich auch mit den Ausscheidungen der Maden auf der Wunde. Dabei konnten unterschiedliche Enzyme identifiziert werden, die sich positiv auf die Wundheilung auswirken. Nach ungefähr 3 bis 4 Tagen sind die Maden satt und haben deutlich an Größe und Gewicht zugenommen. Sollen noch weitere Beläge entfernt werden, müssen neue Maden auf die Wunde gebracht werden. Die Maden vertragen keine Antiseptika und keinen Druck und müssen auf ihre Vitalität überprüft werden. Eine Besiedelung der Wunde mit dem Keim Pseudomonas aeruginosa führt oft zum Absterben der Maden.
Die Biochirurgie ist häufig eine zielführende Methode – gerade für Patienten, die nicht operiert werden können oder wollen. Ihr Einsatz erfolgt vor allem in Kliniken, die Anwendung auf Rezept im ambulanten Bereich ist erst seit Kurzem möglich. Nach einer Anleitung kann diese Methode in allen Bereichen gut eingesetzt werden.
Technisches Débridement – ultrachallassistierte Wundreinigung
Hierbei wird Spüllösung – meist NaCI 0.9 % – zerstäubt und dringt durch den Ultraschall tief ins Gewebe ein. Dadurch werden nur bereits abgestorbenes Gewebe und Beläge entfernt. Eine wichtige Voraussetzung ist hierbei eine gute lokale Schmerztherapie. Es bedarf zudem einer geeigneten Personalschulung, das Gerät muss gewartet werden, und ein geeigneter Raum – der gut gereinigt werden kann – muss zur Verfügung stehen. Des Weiteren ist an die Desinfektion der Handstücke zu denken. Angesichts der entstehenden Aerosole muss die Arbeitssicherheit berücksichtigt werden. Der Anwender benötigt entsprechende Schutzkleidung und muss sich mit Schutzbrille, Mundschutz und flüssigkeitsdichtem Schutzkittel schützen. Schließlich müssen die Anschaffungskosten für das Gerät und die Handstücke bedacht werden.
Auswahl der geeigneten Methode
Diese hängt in erster Linie vom Umfeld des Patienten ab. Die Möglichkeiten in einer Klinik sind stets größer als im Pflegebett daheim. Eventuell gibt es aber die Möglichkeit, den Patienten zum Hausarzt oder in eine Wundambulanz zu bringen. Zudem spielen auch die Begleiterkrankungen und der aktuelle Gerinnungsstatus eine Rolle bei der Auswahl der adäquaten Methode. Eine Grundvoraussetzung ist die Aufklärung des Patienten über die geplanten Maßnahmen sowie über Vorteile und Risiken der in Frage kommenden Methoden und schließlich sein Einverständnis. Die Zielvorstellungen von Patient und Behandelndem sollten besprochen und gemeinsam eine Auswahl getroffen werden.
Zwar trägt der Arzt die Gesamtverantwortung. Die sogenannte Durchführungsverantwortung bleibt jedoch immer bei demjenigen, der die Wundreinigung – gleichgültig in welcher Form – durchführt. Die Anwendung einer bestimmten Methode soll nur nach entsprechender Anleitung erfolgen. Chirurgisches und scharfes Débridement sind immer Aufgabe des Arztes und können nicht delegiert werden.
Weitere Erfolgsfaktoren bei der Wundheilung
Außer einer geeigneten Wundauflage, die das Abheilen der chronischen Wunde unterstützt, ist die Schmerzerfassung – sowohl generell als auch speziell – bei einer Wundreinigung eine wichtige Voraussetzung. Des Weiteren spielt die Schulung des Patienten und/oder seiner Angehörigen entsprechend ihrem Wissensstand eine wichtige Rolle.
Schmerzen
Die verschiedenen Möglichkeiten des Débridements sind für die Betroffenen mit unterschiedlichen Schmerzen verknüpft. Hier ist es Hauptaufgabe der Behandelnden, die Schmerzintensität zu erfragen, z. B. mittels visueller Analogskala (VAS), und eine entsprechende Schmerztherapie anzuwenden. Dies kann lokal, systemisch oder kombiniert erfolgen. Die Abstimmung der rechtzeitigen Gabe von Schmerzmitteln und die Einwirkzeit der Lokalanästhetika erfordern eine vorausschauende Planung. Leider ist dies im praktischen Alltag oft eine Schwachstelle: Die Abläufe lassen sich nicht immer genau planen, oder die Akteure warten mit dem Eingriff nicht bis zum Eintritt der Wirkung. Die erwünschte Therapietreue der Patienten wird dadurch nicht gefördert.
Patientenschulung
Der Alltag stellt für viele Betroffene mit einer chronischen Wunde eine große Herausforderung dar. Der Patient wird mit vielem konfrontiert, was er sich bis dahin nicht vorstellen konnte. Die Gestaltung des Tagesablaufes wird durch Arztbesuche, Untersuchungen und Ambulanzbesuche eingeschränkt.
Verschiedene Möglichkeiten der Freizeitgestaltung, z. B. Schwimmen, entfallen. Diese Einschränkungen bestehen oft über einen langen Zeitraum. Deshalb ist die Anleitung, Schulung und Beratung von Patienten und Angehörigen ein weiterer wichtiger Teil der Behandlung. Hierbei gilt es, das Selbstpflegemanagement zu unterstützen und zu stärken. Auch das Erfassen der Lebensqualität mit einem geeigneten Assessment-Instrument wie dem Würzburger Wundscore spielt eine wichtige Rolle und hilft, den Patienten nicht nur als „Wunde” zu betrachten.
Aspekte wie Nachtschlaf, Arbeitsplatz, finanzielle Probleme und Urlaubsgestaltung sind für den Betroffenen ebenso wichtig wie die fachgerechte Versorgung seiner Wunde. Der Patient soll zum Partner während der Behandlung werden. Dadurch ergibt sich eine bessere Kommunikation und die Möglichkeit, das Ziel „Die Wunde ist abgeheilt” schneller zu erreichen.
Fazit
Die Behandlung von Menschen mit chronischen Wunden stellt an alle an der Versorgung Beteiligten hohe Anforderungen. Vor allem die Schnittstellen zwischen den verschiedenen Bereichen (Hausarzt, Wundambulanz, Gefäßchirurgie, Diabetologe, Pflegedienst, Krankenhaus, Pflegeheim, Orthopädie-Schuhtechniker usw.) bedürfen besonderer Planung und Überleitung. Nur durch ein sinnvolles Miteinander aller kann die Versorgung gelingen.
Die Autorin:
Hildegard Kerler
Onkologische Fachpflege
Pflegetherapeutin Wunde ICW
Algesiologische Fachassistenz
Elisabethenstraße 17
88212 Ravensburg
hildegard.kerler@oberschwabenklinik.de
Begutachteter Beitrag/reviewed paper
Kerler H. Grundlagen der Versorgung chronischer Wunden. Orthopädie Technik, 2014; 65 (8): 52–56
- Prothesenversorgung nach transhumeraler Osseointegration mit Pattern-Recognition-Steuerung – Fallbericht einer Systemumstellung — 14. Februar 2026
- Technologie und Funktionsweise des Prothesenkniegelenks Genium X4 — 13. Februar 2026
- iOrt – Entwicklung einer überwachenden Orthese mit neuartigem optischen Sensorsystem — 11. Februar 2026
- Vasel-Biergans A, Probst W. Wundversorgung für die Pflege – Ein Praxisbuch. 2. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft, 2011
- Deutsches Netzwerk für Qualitätsentwicklung in der Pflege (Hg.). Expertenstandard Pflege von Menschen mit chronischen Wunden. Osnabrück: Hochschule Osnabrück, 2009
- Vasel-Biergans A, Probst W. Wundversorgung für die Pflege – Ein Praxisbuch. 2. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft, 2011
- Deutsches Netzwerk für Qualitätsentwicklung in der Pflege (Hg.). Expertenstandard Pflege von Menschen mit chronischen Wunden. Osnabrück: Hochschule Osnabrück, 2009
- Vasel-Biergans A, Probst W. Wundversorgung für die Pflege – Ein Praxisbuch. 2. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft, 2011
- Deutsches Netzwerk für Qualitätsentwicklung in der Pflege (Hg.). Expertenstandard Decubitusprophylaxe in der Pflege. 1. Aktualisierung. Osnabrück: Hochschule Osnabrück, 2010
- Deutsches Netzwerk für Qualitätsentwicklung in der Pflege (Hg.). Expertenstandard Decubitusprophylaxe in der Pflege. 1. Aktualisierung. Osnabrück: Hochschule Osnabrück, 2010
- Vasel-Biergans A, Probst W. Wundversorgung für die Pflege – Ein Praxisbuch. 2. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft, 2011
- Deutsches Netzwerk für Qualitätsentwicklung in der Pflege (Hg.). Expertenstandard Pflege von Menschen mit chronischen Wunden. Osnabrück: Hochschule Osnabrück, 2009
- Vasel-Biergans A, Probst W. Wundversorgung für die Pflege – Ein Praxisbuch. 2. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft, 2011
- Vasel-Biergans A, Probst W. Wundversorgung für die Pflege – Ein Praxisbuch. 2. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft, 2011
- Vasel-Biergans A, Probst W. Wundversorgung für die Pflege – Ein Praxisbuch. 2. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft, 2011
- Vasel-Biergans A, Probst W. Wundversorgung für die Pflege – Ein Praxisbuch. 2. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft, 2011
- Strohal R, Apelqvist J, Dissemond J, et al. EWMA Document: Debridement. J Wound Care, 2013; 22 (Suppl. 1): S1-S52; deutsche Fassung: http://ewma.org/ongoing/Debridement%20document/German%20Version_EWMA_Debridement_2013.pdf